题目内容
12.硅是重要的半导体材料,构成现代电子工业的基础.硅及其化合物在工业中应用广泛,在国防和航天工业中亦有许多用途.(1)硅原子中最外层电子排布式为2s22p2,该层电子的电子云有3种不同的伸展方向.
(2)温石棉矿是一种硅酸盐类矿物,化学式写作氧化物形式为6MgO•4SiO2•4H2O,其中原子半径最大的元素在周期表中的位置是第三周期第IIA族.SiO2存在与金刚石结构类似的晶体,其中硅氧原子之间以b相结合.
a.离子键 b.极性键 c.非极性键 d.范德华力
(3)甲硅烷(SiH4)是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水.在室温下,10g SiH4自燃放出热量446kJ,请写出其燃烧的热化学方程式:SiH4(l)+2O2(g)=SiO2(S)+2H2O(l)+1427.2 kJ;
(4)SiH4的热稳定性不如CH4,其原因是非金属性C>Si,它们的气态氢化物的热稳定性CH4>SiH4.工业上硅铁可以用于冶镁.以煅白(CaO•MgO)为原料与硅铁(含硅75%的硅铁合金)混合,置于密闭设备中于1200℃发生反应:
2(CaO•MgO)(s)+Si(s)?Ca2SiO4 (l)+2Mg(g)
(5)常温下镁的还原性强于硅.上述方法能够获得镁的原因是:1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动.
(6)若上述反应在容积为a L的密闭容器中发生,一定能说明反应已达平衡的是bc(选填编号).
a.反应物不再转化为生成物
b.炉内Ca2SiO4与CaO•MgO的质量比保持不变
c.反应放出的总热量不再改变
d.单位时间内,n(CaO•MgO)消耗:n(Ca2SiO4)生成=2:1
若b g煅白经t min反应后转化率达70%,该时段内Mg的生成速率是$\frac{0.7b}{96at}$mol/(L•min).
分析 (1)Si原子序数为14,最外层3个电子层,最外层电子数为4;该原子中含有3个s轨道、6个p轨道,共有3种伸展方向;
(2)二氧化硅晶体和金刚石晶体类似都属于原子晶体,硅氧原子之间以共价键结合,不同原子之间是极性键;
(3)根据甲硅烷的质量计算1mol甲硅烷燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题;
(4)根据元素周期律知识:同主族从上到下,氢化物的稳定性逐渐减弱来回答;
(5)根据化学平衡移动原理来回答;
(6)根据化学平衡状态的特征分析,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化;一定条件下若反应达到最大限度,说明达到了平衡状态;根据v=$\frac{△c}{△t}$来计算化学反应速率.
解答 解(1)Si原子序数为14,最外层3个电子层,最外层电子数为4,故最外层电子排布式为:2s22p2;该原子中含有3个s轨道、6个p轨道,s能级电子云的形状为球形,无伸展方向,p层共有3种伸展方向,故答案为:2s22p2;3;
(2)二氧化硅晶体和金刚石晶体类似都属于原子晶体,硅氧原子之间以极性共价键结合,故答案为:b;
(3)n(SiH4)=$\frac{10g}{32g/mol}$=$\frac{10}{32}$mol,则1molSiH4燃烧放出的热量为:446kJ×$\frac{32}{10}$=1427.2kJ,反应的化学方程式为:SiH4+O2=SiO2+2H2O,则热化学方程式为:SiH4(g)+O2(g)=SiO2(g)+2H2O(l)△H=-1427.2kJ/mol,故答案为:SiH4(g)+O2(g)=SiO2(g)+2H2O(l)△H=-1427.2kJ/mol;
(4)根据元素周期律,非金属性C>Si,则它们的气态氢化物的热稳定性CH4>SiH4,故答案为:非金属性C>Si,它们的气态氢化物的热稳定性CH4>SiH4;
(5)1200℃时发生反应为2(CaO•MgO)(s)+Si(s)?Ca2SiO4 (l)+2Mg(g),此时镁以蒸气的形式逸出,使平衡向正反应方向移动,使得化学反应能发生,
故答案为:1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动;
(6)a.化学平衡是动态平衡,反应物不再转化为生成物,则是证明反应结束的,故错误;
b.炉内Ca2SiO4与CaO•MgO的质量比保持不变,达到了平衡,故正确;
c.反应放出的热量不再改变,证明正逆反应速率是相等的,各个组分的浓度不随时间的变化而改变,故正确;
d.单位时间内,n(CaO•MgO)消耗:n(Ca2SiO4)生成=2:1,不能证明正逆反应速率相等,故错误,
Mg的生成速率v=$\frac{\frac{b}{96}×70%}{at}$$\frac{0.7b}{96at}$=mol/(L•min),
故答案为:bc;$\frac{0.7b}{96at}$mol/(L•min).
点评 本题目综合考查学学生物质的结构和化学键、化学反应速率的计算、化学平衡状态的判断以及元素周期律知识,是一道知识的灵活应用题目,注意能力的培养是关键,难度大.

| 元素 | 结构或性质信息 |
| X | 其原子最外层电子数是内层电子数的2倍 |
| Y | 基态原子最外层电子排布为nsnnpn+1 |
| Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| M | 单质在常温、常压下是气体.基态原子的M层上有1个未成对的p电子 |
| Q | 其与X形成的合金为目前用量最多的金属材料 |
(2)比较Y元素与氧元素的第一电离能N>O;X和Z形成的化合物XZ2为一种液体溶剂,其分子中的σ键和π键数目之比为1:1.
(3)写出实验室制备M单质的离子方程式MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O.
(4)M的气态氢化物和氟化氢相比(写化学式)
稳定性强的是HF,其原因是因为元素非金属性F>Cl,所以HF稳定;
沸点高的是HF,其原因是因为HF分子之间存在氢键,所以HF沸点高.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
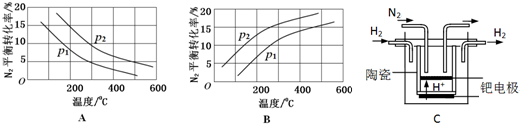
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有C=C键的数目为3 NA | |
| C. | 常温常压下,14 g由N2和CO组成的混合气体含有的电子总数为7 NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2 NA |
| a | b | c | d | |
| 反应前质量(g) | 8 | 10 | 1 | 25 |
| 反应后质量(g) | 未测 | 24 | 2 | 16 |
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:3 |
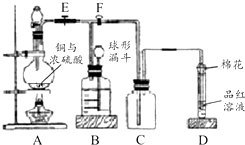 某课外兴趣小组为探究铜跟浓硫酸反应情况,用如图所示装置进行实验.
某课外兴趣小组为探究铜跟浓硫酸反应情况,用如图所示装置进行实验.
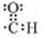 ;E一→F反应类型为缩聚反应.
;E一→F反应类型为缩聚反应. .
. .
.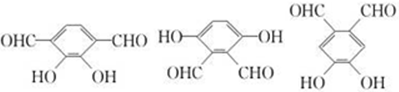 (2种即可).
(2种即可).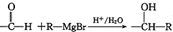 现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J(
现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J( ),则
),则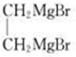 ,
,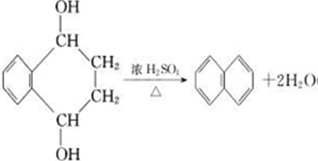 .
.
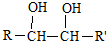 $\stackrel{HIO_{4}}{→}$RCHO+R′CHO
$\stackrel{HIO_{4}}{→}$RCHO+R′CHO . B→H的反应类型是取代反应.
. B→H的反应类型是取代反应.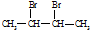 +2NaOH
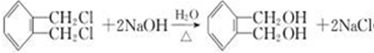
+2NaOH CH3-C≡C-CH3+2NaBr+2H2O.
CH3-C≡C-CH3+2NaBr+2H2O.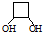 .
.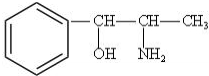 构简式如右图所示,其合成路线如下:A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH溶液/△}$C$→_{③}^{Cu/△}$D$→_{④}^{E}$F$→_{⑤}^{Fe、HCl}$PPA,其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去.已知:
构简式如右图所示,其合成路线如下:A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH溶液/△}$C$→_{③}^{Cu/△}$D$→_{④}^{E}$F$→_{⑤}^{Fe、HCl}$PPA,其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去.已知: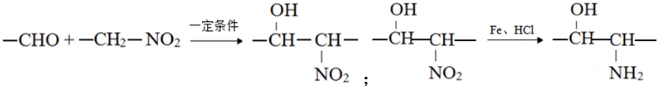
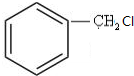 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$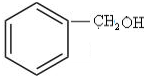 +NaCl.
+NaCl.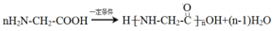 .
.