题目内容
6. 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:(1)Q的电子排布图为
 ,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答).
,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答).(2)X2P和ZP2固态时均为分子晶体,但熔点X2P比ZP2高得多,原因是H2O分子存在分子间氢键.
(3)固体A是离子晶体,结构类似于CsCl,组成中含W的质量分数为73.7%,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,该物质适当加热就分解成两种单质气体.该物质的电子式
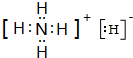 ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
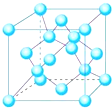
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.(4)Z单质有三类异形体,其中一种骨架型原子晶体的立方晶胞如图,计算晶体中Z原子的空间利用率为33.95%( $\sqrt{2}$=1.41,$\sqrt{3}$=1.73)
分析 有X、Y、Z、W、P、Q六种前两周期的主族元素,由原子序数X<Y,原子半径X<Y,可知X只能处于第一周期,其余元素处于第二周期,故X为H元素;Y、Z、W、P、Q原子序数依次增大,原子半径依Y、Z、W、P、Q依次减小,则最外层电子数依次增大,它们最外层电子数之和为26-1=25,最外层电子数只能分别为3、4、5、6、7,故Y为B、Z为C、W为N、P为O、Q为F.
(1)根据核外电子排布画出其电子排布式;计算BF3中心原子B原子价层电子对数确定其杂化方式;同周期随原子序数增大,第一电离能呈增大趋势,但原子核外电子处于半满、全满、全空时,能量较低,第一电离能高于同周期相邻元素;
(2)水分子之间存在氢键,熔点较高;
(3)固体A是离子晶体,结构类似于CsCl,组成中含N的质量分数为73.7%,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,该物质适当加热就分解成两种单质气体,该物质为NH4H,与水反应生成氢气与一水合氨;
(4)碳单质有三类异形体,其中一种骨架型原子晶体的立方晶胞如图: ,以内部碳原子进行研究,每个碳原子与周围4个碳原子紧密相邻,并形成正四面体结构,设碳原子半径为a,则正四面体中心碳原子与顶点碳原子距离为2a,顶点到底面的距离为(2a+$\frac{2a}{3}$)=$\frac{8a}{3}$,设正四面体的棱长为x,则斜高为$\frac{\sqrt{3}}{2}$x,底面中心到边的距离为$\frac{\sqrt{3}}{2}$x×$\frac{1}{3}$=$\frac{\sqrt{3}}{6}$x,由勾股定理计算x的值,再计算晶胞体积,根据均摊法计算晶胞中碳原子数目,计算晶胞中碳原子总体积,进而计算空间利用率.
,以内部碳原子进行研究,每个碳原子与周围4个碳原子紧密相邻,并形成正四面体结构,设碳原子半径为a,则正四面体中心碳原子与顶点碳原子距离为2a,顶点到底面的距离为(2a+$\frac{2a}{3}$)=$\frac{8a}{3}$,设正四面体的棱长为x,则斜高为$\frac{\sqrt{3}}{2}$x,底面中心到边的距离为$\frac{\sqrt{3}}{2}$x×$\frac{1}{3}$=$\frac{\sqrt{3}}{6}$x,由勾股定理计算x的值,再计算晶胞体积,根据均摊法计算晶胞中碳原子数目,计算晶胞中碳原子总体积,进而计算空间利用率.
解答 解:有X、Y、Z、W、P、Q六种前两周期的主族元素,由原子序数X<Y,原子半径X<Y,可知X只能处于第一周期,其余元素处于第二周期,故X为H元素;Y、Z、W、P、Q原子序数依次增大,原子半径依Y、Z、W、P、Q依次减小,则最外层电子数依次增大,它们最外层电子数之和为26-1=25,最外层电子数只能分别为3、4、5、6、7,故Y为B、Z为C、W为N、P为O、Q为F.
(1)Q为F元素,其电子排布图为 ,BF3中心原子B原子价层电子对数为3+$\frac{3-1×3}{2}$=3,故B原子采取sp2杂化,同周期随原子序数增大,第一电离能呈增大趋势,但N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:B<C<O<N<F,
,BF3中心原子B原子价层电子对数为3+$\frac{3-1×3}{2}$=3,故B原子采取sp2杂化,同周期随原子序数增大,第一电离能呈增大趋势,但N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:B<C<O<N<F,
故答案为: ;sp2杂化;B<C<O<N<F;
;sp2杂化;B<C<O<N<F;
(2)H2O和CO2固态时均为分子晶体,但H2O分子存在分子间氢键,熔点H2O比CO2高得多,
故答案为:H2O分子存在分子间氢键;
(3)固体A是离子晶体,结构类似于CsCl,组成中含N的质量分数为73.7%,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,该物质适当加热就分解成两种单质气体,该物质为NH4H,该物质的电子式为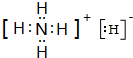 ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑,
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑,
故答案为: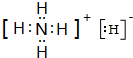 ;NH4H+H2O=NH3•H2O+H2↑;
;NH4H+H2O=NH3•H2O+H2↑;
(4)碳单质有三类异形体,其中一种骨架型原子晶体的立方晶胞如图: ,以内部碳原子进行研究,每个碳原子与周围4个碳原子紧密相邻,并形成正四面体结构,设碳原子半径为a,则正四面体中心碳原子与顶点碳原子距离为2a,顶点到底面的距离为(2a+$\frac{2a}{3}$)=$\frac{8a}{3}$,设正四面体的棱长为x,则斜高为$\frac{\sqrt{3}}{2}$x,底面中心到边的距离为$\frac{\sqrt{3}}{2}$x×$\frac{1}{3}$=$\frac{\sqrt{3}}{6}$x,由勾股定理:($\frac{\sqrt{3}}{6}$x)2+($\frac{8}{3}$a)2=($\frac{\sqrt{3}}{2}$x)2,解得x=$\frac{4\sqrt{6}}{3}$a,故晶胞棱长为$\frac{4\sqrt{6}}{3}$a×2×$\frac{\sqrt{2}}{2}$=$\frac{8\sqrt{3}}{3}$a,故晶胞的体积为($\frac{8\sqrt{3}}{3}$a)3=$\frac{512\sqrt{3}}{9}$a3,晶胞中碳原子数目为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,碳原子总体积为8×$\frac{4}{3}$πa3,故晶体中碳原子原子的空间利用率为(8×$\frac{4}{3}$πa3÷$\frac{512\sqrt{3}}{9}$a3)×100%=33.95%,
,以内部碳原子进行研究,每个碳原子与周围4个碳原子紧密相邻,并形成正四面体结构,设碳原子半径为a,则正四面体中心碳原子与顶点碳原子距离为2a,顶点到底面的距离为(2a+$\frac{2a}{3}$)=$\frac{8a}{3}$,设正四面体的棱长为x,则斜高为$\frac{\sqrt{3}}{2}$x,底面中心到边的距离为$\frac{\sqrt{3}}{2}$x×$\frac{1}{3}$=$\frac{\sqrt{3}}{6}$x,由勾股定理:($\frac{\sqrt{3}}{6}$x)2+($\frac{8}{3}$a)2=($\frac{\sqrt{3}}{2}$x)2,解得x=$\frac{4\sqrt{6}}{3}$a,故晶胞棱长为$\frac{4\sqrt{6}}{3}$a×2×$\frac{\sqrt{2}}{2}$=$\frac{8\sqrt{3}}{3}$a,故晶胞的体积为($\frac{8\sqrt{3}}{3}$a)3=$\frac{512\sqrt{3}}{9}$a3,晶胞中碳原子数目为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,碳原子总体积为8×$\frac{4}{3}$πa3,故晶体中碳原子原子的空间利用率为(8×$\frac{4}{3}$πa3÷$\frac{512\sqrt{3}}{9}$a3)×100%=33.95%,
故答案为:33.95%.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化轨道、电离能、氢键、电子式、晶胞计算,(3)(4)为易错点,中学较少涉及氢化铵,(4)中关键是计算晶胞棱长,需要学生具备一定的空间想象力与数学计算能力,难度较大.

| A. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| B. | 小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 蛋白质、淀粉、油脂等都能在人体内水解并提供能量 | |
| D. | 纯净的二氧化硅是现代光学及光纤制品的基本原料 |
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有C=C键的数目为3 NA | |
| C. | 常温常压下,14 g由N2和CO组成的混合气体含有的电子总数为7 NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2 NA |
| A. | 0.10mol•L-1 | B. | 0.15mol•L-1 | C. | 0.225mol•L-1 | D. | 0.30mol•L-1 |
| A. |  称取食盐 | B. |  稀释浓硫酸 | C. |  检查气密性 | D. |  点燃酒精灯 |
| A. | 10℃时,粉末状锌与3 mol/L硫酸溶液反应 | |
| B. | 50℃时,粉末状锌与3 mol/L硫酸溶液反应 | |
| C. | 10℃时,块状锌与3 mol/L硫酸溶液反应 | |
| D. | 50℃时,块状锌与3 mol/L硫酸溶液反应 |

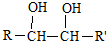 $\stackrel{HIO_{4}}{→}$RCHO+R′CHO
$\stackrel{HIO_{4}}{→}$RCHO+R′CHO . B→H的反应类型是取代反应.
. B→H的反应类型是取代反应.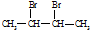 +2NaOH
+2NaOH CH3-C≡C-CH3+2NaBr+2H2O.
CH3-C≡C-CH3+2NaBr+2H2O.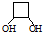 .
.
 有A、B、C、B、D、E五种元素,B原子得到一个电子后3P轨道全充满,A+比B形成的简单离子少一个电子层,C原子的P轨道半充满,它形成的氢化物的沸点是同主族元素的氢化物中最低的,D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%.请回答:
有A、B、C、B、D、E五种元素,B原子得到一个电子后3P轨道全充满,A+比B形成的简单离子少一个电子层,C原子的P轨道半充满,它形成的氢化物的沸点是同主族元素的氢化物中最低的,D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%.请回答: