题目内容
9.某兴趣小组的同学发现将一定量的铁与浓硫酸混合加热时,观察到铁完全溶解,并产生大量气体.为此他们设计了如图装置验证所产生的气体.(1)写出下列几种装置的作用:B防止倒吸,C验证有SO2生成,同时除去SO2,G防止空气中的H2O进入F.
(2)证明有SO2生成的现象是酸性高锰酸钾溶液颜色变浅.
(3)可以证明气体A装置生成气体中含有H2的实验现象是E中:黑色(CuO)变成红色(Cu),F中:白色粉末变成蓝色.如果去掉装置D,还能否根据F中的现象判断气体中有H2?不能(填“能”或“不能”),原因是混合气体中可能有H2O,会干扰H2的检验.
(4)反应后A的溶液中含有Fe3+和Fe2+,检验其中的Fe2+的方法是取少量A溶液,滴加酸性高锰酸钾溶液,若红色褪去,则证明有Fe2+;检验其中Fe3+的方法是取少量A溶液,滴加KI和淀粉溶液,若溶液变为蓝色,则证明有Fe3+.

分析 (1)熄灭A装置中酒精灯时,会造成倒吸;酸性高锰酸钾溶液能和二氧化硫发生反应而褪色;空气中的H2O会进入F产生影响;
(2)二氧化硫能和酸性高锰酸钾溶液反应而使其褪色;
(3)氢气和氧化铜反应生成铜单质,水能使无水硫酸铜变蓝,加热时水会蒸发而导致产生的气体中含有水蒸气,从而造成干扰;
(4)亚铁离子能使酸性高锰酸钾溶液褪色;碘单质遇到淀粉会变蓝色,据此检验离子即可.
解答 解:(1)熄灭A装置中酒精灯时,A装置中气体冷却压强减小,C装置中溶液易进入A试管中产生倒吸现象,所以B装置的作用是防止倒吸;酸性高锰酸钾溶液有强氧化性,二氧化硫能和酸性高锰酸钾溶液发生氧化还原反应而使其褪色,所以酸性高锰酸钾的作用是:验证有SO2生成,同时除去SO2;空气中含有水蒸气,如果没有G装置,水蒸气进入F装置干扰实验,所以G的作用是:防止空气中的H2O进入F,
故答案为:防止倒吸;验证有SO2生成,同时除去SO2;防止空气中的H2O进入F;
(2)二氧化硫有还原性,酸性高锰酸钾有强氧化性,二者能发生氧化还原反应而使酸性高锰酸钾溶液颜色变浅,
故答案为:酸性高锰酸钾溶液颜色变浅;
(3)生成的气体经洗气和干燥后剩余的气体就是氢气,氢气有还原性能和氧化铜在加热条件下发生置换反应生成铜单质,生成的水遇无水硫酸铜时白色固体变蓝色,所以证明含有氢气的现象是:E中黑色(CuO)变成红色(Cu),F中白色粉末变成蓝色;制取的气体中含有水蒸气,如果去掉D装置,会干扰H2的检验,所以不能,
故答案为:黑色(CuO)变成红色(Cu);白色粉末变成蓝色;不能;因为混合气体中可能含H2O,会干扰H2的检验;
(4)酸性高锰酸钾有强氧化性,能氧化二氧化硫而使其褪色,所以检验亚铁离子的方法是:取A的溶液,滴加酸性高锰酸钾溶液,若红色褪去,证明有Fe2+,铁离子和碘离子之间可以发生反应,生成碘单质和亚铁离子,所以取少量A溶液,滴加KI和淀粉溶液,若溶液变为蓝色,则证明有Fe3+,
故答案为:取A的溶液,滴加酸性高锰酸钾溶液,若红色褪去,证明有Fe2+;取少量A溶液,滴加KI和淀粉溶液,若溶液变为蓝色,则证明有Fe3+.
点评 本题考查综合实验探究知识,属于综合知识的考查,难度不大,意在考查考生对化学实验基本方法和技能的掌握情况.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| 元素 | 结构或性质信息 |
| X | 其原子最外层电子数是内层电子数的2倍 |
| Y | 基态原子最外层电子排布为nsnnpn+1 |
| Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| M | 单质在常温、常压下是气体.基态原子的M层上有1个未成对的p电子 |
| Q | 其与X形成的合金为目前用量最多的金属材料 |
(2)比较Y元素与氧元素的第一电离能N>O;X和Z形成的化合物XZ2为一种液体溶剂,其分子中的σ键和π键数目之比为1:1.
(3)写出实验室制备M单质的离子方程式MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O.
(4)M的气态氢化物和氟化氢相比(写化学式)
稳定性强的是HF,其原因是因为元素非金属性F>Cl,所以HF稳定;
沸点高的是HF,其原因是因为HF分子之间存在氢键,所以HF沸点高.
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有C=C键的数目为3 NA | |
| C. | 常温常压下,14 g由N2和CO组成的混合气体含有的电子总数为7 NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2 NA |

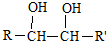 $\stackrel{HIO_{4}}{→}$RCHO+R′CHO
$\stackrel{HIO_{4}}{→}$RCHO+R′CHO . B→H的反应类型是取代反应.
. B→H的反应类型是取代反应.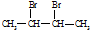 +2NaOH
+2NaOH CH3-C≡C-CH3+2NaBr+2H2O.
CH3-C≡C-CH3+2NaBr+2H2O. .
.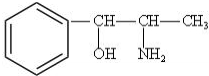 构简式如右图所示,其合成路线如下:A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH溶液/△}$C$→_{③}^{Cu/△}$D$→_{④}^{E}$F$→_{⑤}^{Fe、HCl}$PPA,其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去.已知:
构简式如右图所示,其合成路线如下:A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH溶液/△}$C$→_{③}^{Cu/△}$D$→_{④}^{E}$F$→_{⑤}^{Fe、HCl}$PPA,其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去.已知: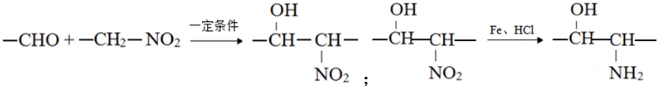
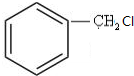 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$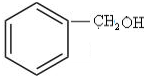 +NaCl.
+NaCl.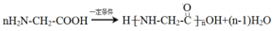 .
.
 有A、B、C、B、D、E五种元素,B原子得到一个电子后3P轨道全充满,A+比B形成的简单离子少一个电子层,C原子的P轨道半充满,它形成的氢化物的沸点是同主族元素的氢化物中最低的,D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%.请回答:
有A、B、C、B、D、E五种元素,B原子得到一个电子后3P轨道全充满,A+比B形成的简单离子少一个电子层,C原子的P轨道半充满,它形成的氢化物的沸点是同主族元素的氢化物中最低的,D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%.请回答: