题目内容
11.下列图示与对应的叙述相符的是 ( )| A. |  表示某吸热反应分别在有、无催化剂的情兄下反应过程中的能量变化 | |
| B. | 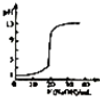 表示常温下,0.1 OOOmoi/LNaOH 溶液液滴定 20.00mL、0.0100/LHCl 溶液 所得到的滴定曲线 | |
| C. | 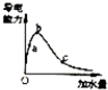 表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c>a>b | |
| D. | 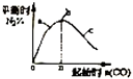 表示反应4CO+2NO2(g)?N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体识分数变化情况,由图可知NO2的转化率 c>b>a |
分析 A、当反应物的能量高于生成物的能量时,反应是放热反应,催化剂是通过降低反应的活化能来加快化学反应速率的;
B、强碱滴定盐酸溶液时,盐酸能完全电离,根据盐酸的浓度确定其pH即可;
C、冰醋酸加水,溶解,离子浓度增大,导电能力增强达到平衡后继续加入水促进醋酸电离,但离子浓度减小导电能力减小;
D、根据增大反应物量会增大另一种物质的转化率来判断.
解答 解:A、催化剂是通过降低反应的活化能来加快化学反应速率的,加入催化剂后活化能会降低,但是图中信息得出:反应物的能量高于生成物的能量,反应是放热反应,故A错误;
B、强碱强氧化钠滴定盐酸溶液时,开始20.00mL0.1000mol•L-1盐酸溶液pH等于2,不是1,故B错误;
C、冰醋酸加水,溶解,离子浓度增大,导电能力增强达到平衡后继续加入水促进醋酸电离,但离子浓度减小导电能力减小,图象符合离子浓度变化,导电能能力b>a>c,a、b、c三点醋酸的电离程度:a<b<c,故C错误;
D、反应4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0,在其他条件不变的情况下增大起始物CO的物质的量,二氧化氮转化率增大,NO2的转化率c>b>a,故D正确.
故选D.
点评 注意识图能力是解决问题的关键,考查学生对质的梳理和归纳能力,综合性较强,难度较大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
19.六氯丙烷(C3H2Cl6的同分异构体有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
6.下列实验操作、现象和结论均正确的是( )


| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②将铜丝向下移动使其与浓硝酸接触 | 产生红棕色气体,用排水法收集气体 | 可以用该装置制备NO2 |
| C | ③光照 | 试管颜色变浅,出现油状滴液,少量白雾 | 甲烷与氯水发生取代反应 |
| D | 打开分液漏斗 | 右侧试管中出现白色沉淀 | 酸性:HNO3>H2CO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
16.化学与生产、生活、社会密切相关,下列说法不正确的是( )
| A. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| B. | 小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 蛋白质、淀粉、油脂等都能在人体内水解并提供能量 | |
| D. | 纯净的二氧化硅是现代光学及光纤制品的基本原料 |
20.X、Y、Z、M、Q是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表
(1)Q元素基态原子的电子排布式是1s22s22p63s23p63d64s2.
(2)比较Y元素与氧元素的第一电离能N>O;X和Z形成的化合物XZ2为一种液体溶剂,其分子中的σ键和π键数目之比为1:1.
(3)写出实验室制备M单质的离子方程式MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O.
(4)M的气态氢化物和氟化氢相比(写化学式)
稳定性强的是HF,其原因是因为元素非金属性F>Cl,所以HF稳定;
沸点高的是HF,其原因是因为HF分子之间存在氢键,所以HF沸点高.
| 元素 | 结构或性质信息 |
| X | 其原子最外层电子数是内层电子数的2倍 |
| Y | 基态原子最外层电子排布为nsnnpn+1 |
| Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| M | 单质在常温、常压下是气体.基态原子的M层上有1个未成对的p电子 |
| Q | 其与X形成的合金为目前用量最多的金属材料 |
(2)比较Y元素与氧元素的第一电离能N>O;X和Z形成的化合物XZ2为一种液体溶剂,其分子中的σ键和π键数目之比为1:1.
(3)写出实验室制备M单质的离子方程式MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O.
(4)M的气态氢化物和氟化氢相比(写化学式)
稳定性强的是HF,其原因是因为元素非金属性F>Cl,所以HF稳定;
沸点高的是HF,其原因是因为HF分子之间存在氢键,所以HF沸点高.
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有C=C键的数目为3 NA | |
| C. | 常温常压下,14 g由N2和CO组成的混合气体含有的电子总数为7 NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2 NA |
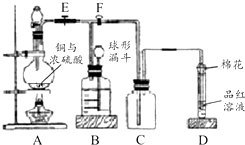 某课外兴趣小组为探究铜跟浓硫酸反应情况,用如图所示装置进行实验.
某课外兴趣小组为探究铜跟浓硫酸反应情况,用如图所示装置进行实验.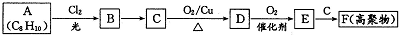
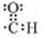 ;E一→F反应类型为缩聚反应.
;E一→F反应类型为缩聚反应. .
.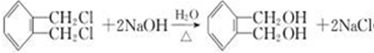 .
.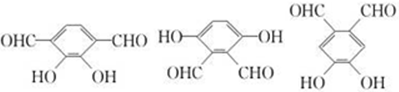 (2种即可).
(2种即可).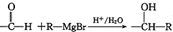 现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J(
现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J( ),则
),则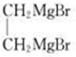 ,
,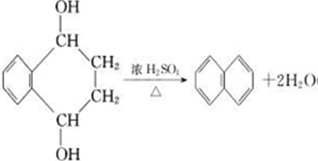 .
.