题目内容
13.一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:CH3CH2OH+O2=CH3COOH+H2O.下列有关说法不正确的是( )| A. | 检测时,电解质溶液中的H+向正极移动 | |
| B. | 若有 0.4 mol电子转移,则消耗 2.24 L氧气 | |
| C. | 正极上发生还原反应,负极上发生氧化反应 | |
| D. | 负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+ |
分析 酸性乙醇燃料电池的负极反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+,正极应为O2得电子被还原,电极反应式为:O2+4e-+4H+═2H2O,正负极相加可得电池的总反应式为:CH3CH2OH+O2═CH3COOH+H2O,可根据电极反应式判断离子和电子的转移问题.
解答 解:A.原电池中,阳离子向正极移动,则电解质溶液中的H+向正极移动,故A正确;
B.氧气得电子被还原,化合价由0价降低到-2价,若有0.4mol电子转移,则应有0.1mol氧气被还原,在标准状况下的体积为2.24L,没有指明标准状况下,故B错误;
C.燃料电池中,氧气在正极得电子发生还原反应生成水,乙醇在负极上发生氧化反应生成乙酸,故C正确;
D.酸性乙醇燃料电池中,乙醇在负极上失电子生成乙酸,则负极反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+,故D正确;
故选B.
点评 本题考查酸性乙醇燃料电池知识,题目难度中等,注意题中乙醇被氧化为乙酸的特点,答题中注意审题,根据题给信息解答.

练习册系列答案
相关题目
3.下列实验装置设计合理,且能达到相应实验目的是:( )
| 选项 | 实验装置 | 实验目的 |
| A |  | 加热硫酸铜晶体获得无水硫酸铜 |
| B |  | 加热碳酸氢钠,证明它能分解释放出二氧化碳气体 |
| C |  | 实验室制取氯气 |
| D |  | 用中和滴定的方法测定某氢氧化钠待测液的浓度 |
| A. | A | B. | B | C. | C | D. | D |
4.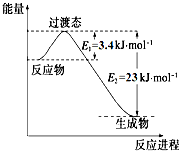 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气.如图表示恒压容器中0.5mol CO2和1.5mol H2转化率达80%时的能量变化示意图. 能判断该反应达到化学平衡状态的依据是bd.
a.容器中压强不变
b.H2的体积分数不变c.
c(H2)=3c(CH3OH)
d.容中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验2条件下平衡常数K=0.17.
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.01mol•L-1 H2C2O4溶液中滴加10mL 0.01mol•L-1NaOH溶液时,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O.
 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气.如图表示恒压容器中0.5mol CO2和1.5mol H2转化率达80%时的能量变化示意图. 能判断该反应达到化学平衡状态的依据是bd.
a.容器中压强不变
b.H2的体积分数不变c.
c(H2)=3c(CH3OH)
d.容中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组[ | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.01mol•L-1 H2C2O4溶液中滴加10mL 0.01mol•L-1NaOH溶液时,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O.
1.化学与科学、技术、社会、环境密切相关,下列叙述正确的是( )
| A. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 | |
| D. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
5. 下表列出了断裂某些化学键所需的能量:
下表列出了断裂某些化学键所需的能量:
请回答下列问题:
(1)如图表示某反应的能量变化关系图,若此能量变化关系 图表示反应H2(g)+$\frac{1}{2}$O2(g)═H2O(g)
△H=-241..8kJ•mol-1,则B=926kJ•mol-1,x=496.4.
 下表列出了断裂某些化学键所需的能量:
下表列出了断裂某些化学键所需的能量:| 化学键 | H-H | Cl-Cl | I-I | O═O | C-Cl | C-H | O-H | H-Cl | H-I |
| 断裂1mol化学键所吸收的能量(kJ) | 436 | 247 | 151 | x | 330 | 413 | 463 | 431 | 299 |
(1)如图表示某反应的能量变化关系图,若此能量变化关系 图表示反应H2(g)+$\frac{1}{2}$O2(g)═H2O(g)
△H=-241..8kJ•mol-1,则B=926kJ•mol-1,x=496.4.
2.化学已渗透到人类生活的各个方面.下列说法正确的是( )
| A. | 氧化亚铁能与酸反应,可用于制作红色涂料 | |
| B. | 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 | |
| C. | 碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 | |
| D. | 维生素C是水溶性维生素,能增强人体抵抗力,有解毒作用 |
3.用括号中的试剂除去各组物质中的少量杂质正确的是( )
| A. | 苯中的甲苯(溴水) | B. | 乙烷中的乙烯(氢气) | ||
| C. | 溴苯中的溴(碘化钾溶液) | D. | 乙醇中的水(新制的CaO) |
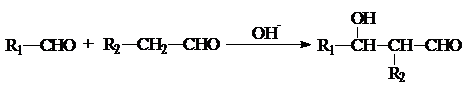 .有机物G(C20H18O4)是一种酯,合成路线如下:
.有机物G(C20H18O4)是一种酯,合成路线如下:
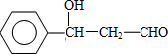 ,F 的结构简式是CH2OHCH2OH;
,F 的结构简式是CH2OHCH2OH;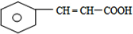 +CH2OHCH2OH$→_{△}^{浓硫酸}$
+CH2OHCH2OH$→_{△}^{浓硫酸}$ +2H2O;
+2H2O;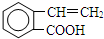
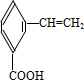 、
、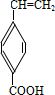 、
、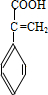 .
.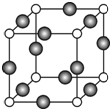 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子. .
.