题目内容
4. 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
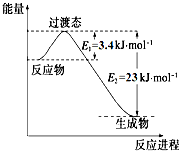
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气.如图表示恒压容器中0.5mol CO2和1.5mol H2转化率达80%时的能量变化示意图. 能判断该反应达到化学平衡状态的依据是bd.
a.容器中压强不变
b.H2的体积分数不变c.
c(H2)=3c(CH3OH)
d.容中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组[ | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.01mol•L-1 H2C2O4溶液中滴加10mL 0.01mol•L-1NaOH溶液时,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O.
分析 (1)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
(2)①依据图表数据列式计算平衡浓度,再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,据此答题;
③根据浓度商Qc与平衡常数K的大小,判断反应进行的方向,进而确定正逆反应的速率的大小关系;
(3)依据盖斯定律进行计算,由$\frac{①-②+③×4}{2}$得出正确结论;
(4)H2C2O4和NaOH反应生成NaHC2O4,NaHC2O4溶液呈酸性说明溶液中电离大于水解,依此比较溶液中HC2O4-、C2O42-、H2C2O4、H+的浓度从大到小的顺序;
(5)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,依此书写电极反应式.
解答 解:(1)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,反应是气体体积减小的放热反应;
a.反应再恒压容器中进行,故容器中压强不变,不能说明反应达到平衡状态,故a错误;
b.H2的体积分数不变,说明反应达到平衡状态,故b正确;
c.平衡时各物质的浓度之比取决于物质的起始物质的量和转化率,故c(H2)=3c(CH3OH),不能说明反应达到平衡状态,故c错误;
d.密度=$\frac{总质量}{体积}$,总质量会变,体积会变,故容器中密度不变,说明反应达到平衡状态,故d正确;
e.2个C=O断裂是正反应,同时有6个H-H断裂也是正反应,故不能说明反应达到平衡状态,故e错误;
故答案为:bd;
(2)①H2O(g)+CO(g)?CO2(g)+H2(g)
初始浓度 0.5mol/L 1mol/L 0 0
转化浓度 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡浓度 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=$\frac{0.2×0.2}{0.3×0.8}$=0.17,
故答案为:0.17;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,所以要使CO的转化率大于水蒸气,则0<$\frac{a}{b}$<1,
故答案为:<1;
③900℃时,当CO、H2O、CO2、H2均为1mol时,浓度商Qc=$\frac{0.5×0.5}{0.5×0.5}$=1>0.17=K,所以此时平衡要逆向移动,故V正<V逆,
故答案为:<;
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
由$\frac{①-②+③×4}{2}$得:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=$\frac{-1275.6kJ/mol-(-566.0kJ/mol)+(-44.0kJ/mol)×4}{2}$-442.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ/mol;
(4)常温下,向10mL 0.01mol•L-1 H2C2O4溶液中滴加10mL 0.01mol•L-1NaOH溶液时,H2C2O4和NaOH反应生成NaHC2O4,由于NaHC2O4溶液显酸性,故溶液中HC2O4-的电离程度大于其水解程度,所以c(C2O42-)>c(H2C2O4),由于氢离子来自水的电离和HC2O4-的电离,则c(H+)>c(C2O42-),HC2O4-的水解程度较小,则c(HC2O4-)>c(C2O42-),所以溶液中各离子浓度大小为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),
故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OCH3+16OH--12e-=2CO32-+11H2O,
故答案为:CH3OCH3+16OH--12e-=2CO32-+11H2O.
点评 本题考查化学平衡的标志、平衡常数的计算及化学平衡移动原理、盖斯定律的计算应用、离子浓度大小的比较、电解池反应原理及电极反应式的书写,知识点较多,综合性很强,难度较大.

 名校课堂系列答案
名校课堂系列答案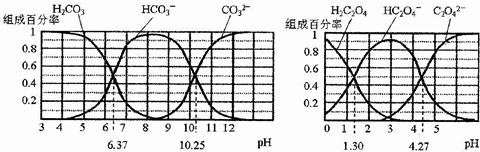
| A. | 在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-) | |
| B. | 反应HCO3-+H2O?H2CO3+OH-的平衡常数为10-10.25 | |
| C. | 0.1mol•L-1NaHC2O4溶液中c(HC2O4-)+c(H2C2O4)=0.1mol•L-1 | |
| D. | 往Na2CO3溶液中加入少量草酸溶液,发生反应:CO32-+H2C2O4=HCO3-+HC2O4- |
| A. | “地沟油”可以制成肥皂,提高资源的利用率 | |
| B. | 食品中大量添加苯甲酸钠等防腐剂,可有效延长其保质期 | |
| C. | 加快开发高效洁净能源转换技术,缓解能源危机 | |
| D. | “APEC蓝”是2014年新的网络词汇,形容2014年APEC会议期间北京蓝蓝的天空,说明京津冀实施道路限行和污染企业停工等措施,对减轻雾霾、保证空气质量是有效的 |
| A. | Na2SiO3溶液中滴加适量稀HCl制硅酸胶体:SiO32-+2H+═H2SiO3(胶体) | |
| B. | 用稀HNO3清洗试管壁上的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| C. | (NH4)2SO4溶液与过量Ba(OH)2溶液混合:NH4++SO42-+Ba2++OH-═BaSO4↓+NH3•H2O | |
| D. | SO2通入氯水中:Cl2+SO2+2H2O═SO42-+2Cl-+4H+ |
| A. | 食品中大量添加苯甲酸钠等防腐剂,可有效延长其保质期 | |
| B. | “地沟油”可以制成肥皂,提高资源的利用率 | |
| C. | 加快开发高效洁净能源转换技术,缓解能源危机 | |
| D. | “A PEC蓝”是2014年新的网络词汇,形容2014年A PEC会议期间北京蓝蓝的天空.说明京津冀实施道路限行和污染企业停工等措施,对减轻雾霾、保证空气质量是有效的 |
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 结合H+的能力:CO32->CN->HCO3->HCOO- | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 25℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水) | |
| D. | 0.1mol/L的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| A. | 检测时,电解质溶液中的H+向正极移动 | |
| B. | 若有 0.4 mol电子转移,则消耗 2.24 L氧气 | |
| C. | 正极上发生还原反应,负极上发生氧化反应 | |
| D. | 负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+ |