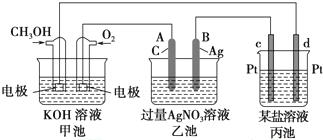
题目内容
18. 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.(1)基态E原子的价电子排布图
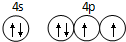 .
.(2)B、C、D三元素第一电离能由大到小的顺序为N>O>C(用元素符号表示)
(3)BD32-中心原子杂化轨道的类型为sp2杂化;CA4+的空间构型为正四面体(用文字描述).
(4)1mol BC-中含有π键的数目为2NA.
(5)D、E元素最简单氢化物的稳定性H2O>H2Se(填化学式),理由是H2O中共价键的键能高于H2Se.
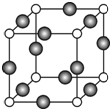
(6)C、F两元素形成的某化合物的晶胞结构如右图所示,则该化合物的化学式是Cu3N,C原子的配位数是6.若相邻C原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为$\frac{103}{4{a}^{3}{N}_{A}}$g/cm3(用含a、NA的符号表示).
分析 A的周期数等于其主族序数,应为H元素,B原子的价电子排布为nsnnpn,n=2,应为C元素,D是地壳中含量最多的元素,应为O元素,则C为N元素,E是第四周期的p区元素且最外层只有2对成对电子,应为Se元素,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子,为Cu元素,以此解答该题.
解答 解:A的周期数等于其主族序数,应为H元素,B原子的价电子排布为nsnnpn,n=2,应为C元素,D是地壳中含量最多的元素,应为O元素,则C为N元素,E是第四周期的p区元素且最外层只有2对成对电子,应为Se元素,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子,为Cu元素,
(1)由以上分析可知E为Se元素,最外层有6个电子,价电子排布图为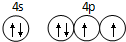 ,故答案为:
,故答案为: ;
;
(2)同周期元素从左到由元素的第一电离能逐渐增大,由于O原子核外价电子排布式2s22p4,而N原子核外价电子排布式2s22p3,2p亚层属于半充满的稳定结构,难失去一个电子,因此第一电离能较大的为N元素,则顺序为N>O>C,故答案为:N>O>C;
(3)CO32-中心原子形成3个σ键,孤电子对数为$\frac{6-2×3}{2}$=0,杂化轨道的类型为sp2,NH4+中心原子形成4个σ键,空间构型为正四面体,
故答案为:sp2;正四面体;
(4)CN-与N2为等电子体,含有C≡N键,则1mol BC-中含有π键的数目为2NA,故答案为:2;
(5)非金属性O>S,元素的非金属性越强,键能越大,对应的氢化物越稳定,则H2O>H2Se,故答案为:H2O;H2Se;H2O中共价键的键能高于H2Se;
(6)由晶胞结构可知,N原子位于定点,个数为8×$\frac{1}{8}$=1,Cu位于棱,个数为12×$\frac{1}{4}$=3,则化学式为Cu3N,晶胞中位于定点和棱心的位置最近,则N原子的配位数是6,
若相邻C原子和F原子间的距离为a cm,则边长为2acm,晶胞的体积为8a3cm3,晶胞的质量为$\frac{206}{{N}_{A}}$g,则密度为$\frac{\frac{206}{{{N}_{A}}_{\;}}}{8{a}^{3}}$g/cm3=$\frac{103}{4{a}^{3}{N}_{A}}$g/cm3,
故答案为:Cu3N; 6;$\frac{103}{4{a}^{3}{N}_{A}}$.
点评 本题考查物质的结构与性质,为高频考点,侧重于学生的分析、计算能力的考查,题目注重对电子排布、晶体类型、熔沸点比较、晶胞计算常考考点的训练,难度中等,注意把握晶胞的计算.

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
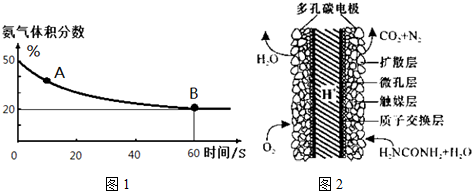
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=0.1mol/L;
NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+.
| A. | 检测时,电解质溶液中的H+向正极移动 | |
| B. | 若有 0.4 mol电子转移,则消耗 2.24 L氧气 | |
| C. | 正极上发生还原反应,负极上发生氧化反应 | |
| D. | 负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+ |
| A. | 甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应 | |
| B. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 | |
| C. | 糖类、油脂和蛋白质都是高分子化合物,都能发生水解反应 | |
| D. | 蛋白质、人造纤维和光导纤维都属于有机高分子化合物 |
| A. | 原子序数:W>X>Y>Z | |
| B. | 原子半径:W>X>Y>Z | |
| C. | W的最高价氧化物的水化物碱性比X的弱 | |
| D. | Y的简单氢化物的稳定性比Z的强 |
 我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品.
我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品. ①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;
①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;