��Ŀ����
����Ŀ����֪��O2��g��+2H2��g��=2H2O��g����H=��483.6kJmol��1
C��s��ʯī��+O2��g��=CO2��g����H=��393.5kJmol��1
CO2��g��+C��s��ʯī��=2CO��g����H=+172.5kJmol��1
��1����д��CO��ˮ������Ӧ���Ȼ�ѧ����ʽ
��2����һ���Ϊ10L���ܱ������У�ͨ��һ������CO��ˮ��������850��ʱ������Ӧ��������CO��ˮ����Ũ�ȱ仯��ͼ����0��4min��ƽ����Ӧ����v��CO��= �� ������ʱ��ƽ�ⳣ��K= �� 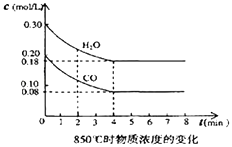
ʱ��/min | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
��3��t�棨����850�棩ʱ������ͬ�����з���������Ӧ�������ڸ����ʵ�Ũ�ȱ仯���ұ���
�ٱ���3min��4min֮�䷴Ӧ����״̬��c1��ֵ0.08mol/L ������ڡ�С�ڻ���ڣ���
�ڷ�Ӧ��4min��5min�䣬ƽ�����淽���ƶ������������µ�ԭ��������ĸ��������5min��6min֮����ֵ�����仯�����ܵ�ԭ���� �� ������ĸ��
a������ˮ���� b�������¶� c��ʹ�ô��� d����������Ũ�ȣ�
���𰸡�
��1��CO��g��+H2O��g��?CO2��g��+H2��g����H=��41.2kJ?mol��1
��2��0.03mol/��L?min����1
��3��ƽ�⣻���ڣ�d��a
���������⣺��1��O2��g��+2H2��g��=2H2O��g����H=��483.6kJmol��1��
C��s��ʯī��+O2��g��=CO2��g����H=��393.5kJmol��1��CO2��g��+C��s��ʯī��=2CO��g����H=+172.5kJmol��1�۽�����ʽ ![]() ��CO��g��+H2O��g��CO2��g��+H2��g����H=
��CO��g��+H2O��g��CO2��g��+H2��g����H= ![]() kJ/mol=��41.2kJmol��1�����Դ��ǣ�CO��g��+H2O��g��CO2��g��+H2��g����H=��41.2kJmol��1����2��0��4min��ƽ����Ӧ����v��CO��=
kJ/mol=��41.2kJmol��1�����Դ��ǣ�CO��g��+H2O��g��CO2��g��+H2��g����H=��41.2kJmol��1����2��0��4min��ƽ����Ӧ����v��CO��= ![]() =
= ![]() mol/��L��min��=0.03 mol/��Lmin�������ݷ���ʽ֪��ƽ��ʱ��c��CO��=��c��CO2��=��c��H2��=��0.20��0.08��mol/L=0.12mol/L��c��CO��=0.08mol/L��c��H2O��=0.18mol/L����ѧƽ�ⳣ��K=
mol/��L��min��=0.03 mol/��Lmin�������ݷ���ʽ֪��ƽ��ʱ��c��CO��=��c��CO2��=��c��H2��=��0.20��0.08��mol/L=0.12mol/L��c��CO��=0.08mol/L��c��H2O��=0.18mol/L����ѧƽ�ⳣ��K= ![]() =
= ![]() =1�����Դ��ǣ�0.03 mol/��Lmin����1����3�����ڸ���850��ʱ������Ӧ����ѧ��Ӧ���ʼӿ죬һ����4minǰ�ﵽ��ѧƽ�⣮����ӱ��пɿ�����Ӧ��3min��4minʱ�ĸ�����Ũ����ͬ����3min��4min֮�䷴ӦӦ����ƽ��״̬�������Ƿ��ȷ�Ӧ���¶����ߣ���ѧƽ�����淴Ӧ�����ƶ���C1��ֵӦ����0.08 mol/L�����Դ��ǣ�ƽ�⣻���ڣ��ڷ�Ӧ��4min��5min�䣬ƽ�����淽���ƶ������������¶ȡ�����������Ũ�ȡ����ٷ�Ӧ��Ũ�ȵ��������𣬹�ѡd������5min��6min֮��COŨ�ȼ��٣�H2OŨ������CO2Ũ������ֻ������ˮ������ʹ��ѧƽ��������Ӧ�����ƶ�����ѡa�����Դ��ǣ�d��a��
=1�����Դ��ǣ�0.03 mol/��Lmin����1����3�����ڸ���850��ʱ������Ӧ����ѧ��Ӧ���ʼӿ죬һ����4minǰ�ﵽ��ѧƽ�⣮����ӱ��пɿ�����Ӧ��3min��4minʱ�ĸ�����Ũ����ͬ����3min��4min֮�䷴ӦӦ����ƽ��״̬�������Ƿ��ȷ�Ӧ���¶����ߣ���ѧƽ�����淴Ӧ�����ƶ���C1��ֵӦ����0.08 mol/L�����Դ��ǣ�ƽ�⣻���ڣ��ڷ�Ӧ��4min��5min�䣬ƽ�����淽���ƶ������������¶ȡ�����������Ũ�ȡ����ٷ�Ӧ��Ũ�ȵ��������𣬹�ѡd������5min��6min֮��COŨ�ȼ��٣�H2OŨ������CO2Ũ������ֻ������ˮ������ʹ��ѧƽ��������Ӧ�����ƶ�����ѡa�����Դ��ǣ�d��a��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���ʼ����������֪ʶ�����ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч�����Լ��Ի�ѧƽ��ļ�������⣬�˽ⷴӦ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��