��Ŀ����
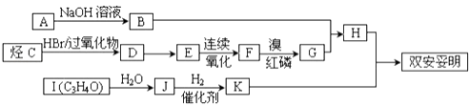
����Ŀ��ֱ���ŷź�SO2���������γ����꣬Σ��������ij��ѧʵ��С����������й�SO2���ʵ�̽����� 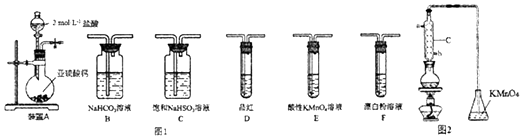
��1��װ��A�з�Ӧ�����ӷ���ʽΪ ��
��2��ѡ��ͼ1����װ�ú�ҩƷ̽��������������������ǿ����
�ټ�ͬѧ��Ϊ����A��C��F��β������˳������װ�ÿ���֤��������ʹη��������ǿ������ͬѧ��Ϊ�÷������������������� ��
�ڱ�ͬѧ��Ƶĺ���ʵ������Ϊ������A��C��β������������ĸ��˳������װ�ã�����װ��C�������� �� ֤�������������ǿ�ڴ���������Ե�ʵ�������� ��
��3��������ͼ2 ��װ��A���Һ��SO2�ĺ�������ȡ10.00mL��Һ��Բ����ƿ�У�����ʹSO2ȫ����������20.00mL 0.1000mol/L��KMnO4����Һ���գ���ַ�Ӧ������0.200Omol/L��KI��Һ�ζ�������KMnO4 �� ����KI��Һ25.00mL��
����֪��5SO2+2MnO4��+2H2O=2Mn2++5SO42��+4H+ �� 10I��+2MnO4��+16H+=2Mn2++5I2+8H2O��
�ٸ�װ��������C������Ϊ �� ˮͨ��C�Ľ���Ϊ ��
�ڲ�Һ��SO2�ĺ���Ϊmol/L��
���𰸡�
��1��2H++CaSO3=Ca2++H2O+SO2��
��2����������ͨ����������Һ������������ԭ��Ӧ����֤��ǿ���Ʊ������ԭ����B��E��D��F����ȥHCl��������Ӱ������ʵ���ã�װ��D��Ʒ�첻��ɫ��F�г��ְ�ɫ����
��3�����������ܣ�b��0.25
���������⣺��1��װ��A��������������Ʒ�Ӧ�����Ȼ��ơ�ˮ�Ͷ����������ӷ���ʽΪ��2H++CaSO3=Ca2++H2O+SO2�������Դ��ǣ�2H++CaSO3=Ca2++H2O+SO2������2���ٰ���A��C��F˳������װ�ã����б��͵����������Ƴ�ȥHCl����������ͨ����������Һ������������ԭ��Ӧ������֤��ǿ���Ʊ������ԭ��������֤��������ʹ����������ǿ����
���Դ��ǣ���������ͨ����������Һ������������ԭ��Ӧ����֤��ǿ���Ʊ������ԭ�����ڴ��������ǿ�����ԡ�����������л�ԭ�ԣ��������ö���������������ֱ�ӷ�Ӧ�ж�������������������ǿ��������֤���������Ա�̼��ǿ���ٽ��̼�����Ա�HClOǿ�����жϣ�Aװ���Ʊ������������������ӷ����Ʊ��Ķ��������л���HCl���ñ��͵����������Ƴ�ȥHCl����ͨ��̼��������Һ��������֤���������Ա�̼��ǿ�������Ը��������Һ������ȥ������̼�еĶ���������Ʒ����Һ���������̼�ж��������Ƿ��������ͨ��F�У���װ������˳��ΪA��C��B��E��D��F������װ��C�������dz�ȥHCl���壬D��Ʒ�첻��ɫ��F�г��ְ�ɫ��������֤�������������ǿ�ڴ����ᣬ
���Դ��ǣ�B��E��D��F����ȥHCl��������Ӱ������ʵ���ã�װ��D��Ʒ�첻��ɫ��F�г��ְ�ɫ��������3���ٸ�װ��������C������Ϊ���������ܣ���ȡ����ԭ��ͨ������ˮ�������������ܽ�ˮ��Ϊb��
���Դ��ǣ����������ܣ�b������10I��+2MnO4��+16H+=2Mn2++5I2+8H2O���������KMnO4���ʵ���Ϊ ![]() ��0.200Omol/L��0.025L=0.001mol��
��0.200Omol/L��0.025L=0.001mol��
�������Һ��SO2��Ӧ��KMnO4���ʵ���Ϊ0.02L��0.1000mol/L��0.001mol=0.001mol��
��5SO2+2MnO4��+2H2O=2Mn2++5SO42��+4H+ �� ���Һ��SO2����Ϊ0.001mol�� ![]() =0.0025mol�����Բ�Һ��SO2�ĺ���Ϊ=
=0.0025mol�����Բ�Һ��SO2�ĺ���Ϊ= ![]() =0.25mol/L��
=0.25mol/L��
���Դ��ǣ�0.25��

����Ŀ����֪��O2��g��+2H2��g��=2H2O��g����H=��483.6kJmol��1
C��s��ʯī��+O2��g��=CO2��g����H=��393.5kJmol��1
CO2��g��+C��s��ʯī��=2CO��g����H=+172.5kJmol��1
��1����д��CO��ˮ������Ӧ���Ȼ�ѧ����ʽ
��2����һ���Ϊ10L���ܱ������У�ͨ��һ������CO��ˮ��������850��ʱ������Ӧ��������CO��ˮ����Ũ�ȱ仯��ͼ����0��4min��ƽ����Ӧ����v��CO��= �� ������ʱ��ƽ�ⳣ��K= �� 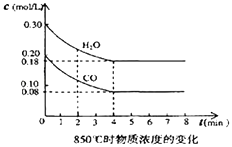
ʱ��/min | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
��3��t�棨����850�棩ʱ������ͬ�����з���������Ӧ�������ڸ����ʵ�Ũ�ȱ仯���ұ���
�ٱ���3min��4min֮�䷴Ӧ����״̬��c1��ֵ0.08mol/L ������ڡ�С�ڻ���ڣ���
�ڷ�Ӧ��4min��5min�䣬ƽ�����淽���ƶ������������µ�ԭ��������ĸ��������5min��6min֮����ֵ�����仯�����ܵ�ԭ���� �� ������ĸ��
a������ˮ���� b�������¶� c��ʹ�ô��� d����������Ũ�ȣ�