��Ŀ����
����Ŀ����ҵ�ϳ�ͨ�����·ֽ�FeSO4�ķ����Ʊ�Fe2O3,�仯ѧ����ʽΪ��2FeSO4![]() Fe2O3+ SO2��+SO3��Ϊ����FeSO4���·ֽ�IJ�������������ʵ����
Fe2O3+ SO2��+SO3��Ϊ����FeSO4���·ֽ�IJ�������������ʵ����
��1��ȡ�����ֽ�õ��Ĺ������ϡ�����ܽ⣬Ϊ������Һ���Ƿ���Fe3+�������Լ���ҩƷ����������� ������ţ���������Լ���ɹ۲������Ϊ ��
A��ϡ���� B������ C��KSCN��Һ D���Ȼ�ͭ��Һ
��2�������·ֽ����������ͨ����ͼ��ʾװ���У��Լ������������ɷ֡�
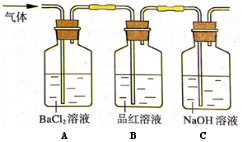
��ش��������⣺
������װ��A�У��۲쵽�а�ɫ�������ɣ���ó���Ϊ �������� ������ڡ�
��װ��C�е�NaOH��Һ�������� ��
���𰸡���1��C����Һ��Ѫ��ɫ��2��BaSO4 ��SO3
��3������SO2���壬��ֹ�ݳ���ɻ�����Ⱦ
��������
�����������1��Fe3����KSCN��Һ��Ѫ��ɫ�����Լ���Fe3������ʵ��Լ���KSCN��Һ����ѡC,����Ϊ��Һ��Ѫ��ɫ����2����װ��A�����۲쵽�а�ɫ�������ɣ���ΪSO2��BaCl2����Ӧ��ֻ����SO3�������ķ�ӦΪSO3+H2O =H2SO4 ��H2SO4+BaCl2 =BaSO4��+2HCl�����Ըó���ΪBaSO4 ����SO3������ڡ�(3)װ��C��NaOH��Һ������������SO2���壬��ֹ�ݳ���ɻ�����Ⱦ��

����Ŀ����֪��O2��g��+2H2��g��=2H2O��g����H=��483.6kJmol��1
C��s��ʯī��+O2��g��=CO2��g����H=��393.5kJmol��1
CO2��g��+C��s��ʯī��=2CO��g����H=+172.5kJmol��1
��1����д��CO��ˮ������Ӧ���Ȼ�ѧ����ʽ
��2����һ���Ϊ10L���ܱ������У�ͨ��һ������CO��ˮ��������850��ʱ������Ӧ��������CO��ˮ����Ũ�ȱ仯��ͼ����0��4min��ƽ����Ӧ����v��CO��= �� ������ʱ��ƽ�ⳣ��K= �� 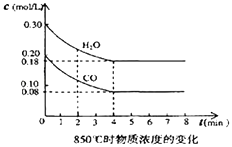
ʱ��/min | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
��3��t�棨����850�棩ʱ������ͬ�����з���������Ӧ�������ڸ����ʵ�Ũ�ȱ仯���ұ���
�ٱ���3min��4min֮�䷴Ӧ����״̬��c1��ֵ0.08mol/L ������ڡ�С�ڻ���ڣ���
�ڷ�Ӧ��4min��5min�䣬ƽ�����淽���ƶ������������µ�ԭ��������ĸ��������5min��6min֮����ֵ�����仯�����ܵ�ԭ���� �� ������ĸ��
a������ˮ���� b�������¶� c��ʹ�ô��� d����������Ũ�ȣ�