题目内容
【题目】铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药物,如图1是它的说明书: 
该药品中Fe2+会缓慢氧化,国家规定该药物中Fe2+的氧化率超过10%即不能再服用.
(1)为了检验某药店出售的“速力菲”是否被氧化,实验室可选用的最常用且最灵敏的检验试剂为(填试剂的名称).
(2)实验室采用H2SO4酸化的KMnO4溶液对“速力菲”中的Fe2+进行滴定(假设药品中其他成分不与KMnO4反应);该反应的离子方程式为: .
(3)称量上述含铁元素质量分数为20.00%的“速力菲”19.00g,将其全部溶于稀硫酸中,配制成1000.00mL溶液.取出20.00mL,用0.01300mol/L的KMnO4溶液滴定,消耗KMnO4溶液体积如图2所示.
①实验前,首先要精确配制0.01300mol/L KMnO4溶液250mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 .
②某同学的滴定方式(夹持部分略去)如图,最合理的是 . 
③由图可知消耗KMnO4溶液体积为mL;
④滴定终点观察到的现象为;
⑤以标准KMnO4溶液滴定样品溶液的浓度,判断以下操作所引起实验结果偏小的是 .
A.滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出
B.未用标准KMnO4溶液润洗滴定管
C.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
D.滴定前仰视,滴定后俯视(标准液)
【答案】
(1)硫氰化钾溶液
(2)8H++MnO4﹣+5Fe2+=5Fe3++Mn2++4H2O
(3)250ml容量瓶;b;19.00;滴入最后一滴KMnO4溶液,溶液由浅绿色变为紫红色,且半分钟内颜色不再改变滴定达到终点;AD
【解析】解:(1)Fe2+氧化会生成Fe3+ , 可用硫氰化钾溶液检验Fe3+的存在,溶液变成血红色,所以答案是:硫氰化钾溶液;(2)MnO4﹣具有氧化性能将Fe2+氧化生成Fe3+ , 自身被还原成Mn2+ , 反应的离子方程式为:8H++MnO4﹣+5Fe2+=5Fe3++Mn2++4H2O,所以答案是:8H++MnO4﹣+5Fe2+=5Fe3++Mn2++4H2O;(3)①配制0.01300mol/L KMnO4溶液250mL,配制时需要的玻璃仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,所以答案是:250mL容量瓶;②根据题意用标准液高锰酸钾滴定滤液1,滤液1待测液用锥形瓶盛放,高锰酸钾具有强氧化性,会腐蚀橡胶,应装在酸式滴定管中,b符合,所以答案是:b;③滴定前读数是0.80mL,滴定终点读数是19.80mL,则消耗KMnO4溶液体积为19.80mL﹣0.80mL=19.00mL,所以答案是:19.00;④KMnO4溶液呈紫红色,硫酸亚铁反应完毕,滴入最后一滴KMnO4溶液,溶液由浅绿色变为紫红色,且半分钟内颜色不再改变滴定达到终点,所以答案是:滴入最后一滴KMnO4溶液,溶液由浅绿色变为紫红色,且半分钟内颜色不再改变滴定达到终点;⑤A.滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出,待测液的物质的量偏小,造成V(标准)偏小,则c(待测)偏小,故A正确; B.未用标准KMnO4溶液润洗滴定管,溶液被稀释,造成V(标准)偏大,c(待测)偏大,故B错误; C.滴定接近终点时,用少量蒸馏水冲洗瓶内壁,待测液的物质的量不变,对V(标准)无影响,c(待测)不变,故C错误; D.滴定前仰视,滴定后俯视(标准液),造成V(标准)偏小,则c(待测)偏小,故D正确;所以答案是:AD.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】已知:O2(g)+2H2(g)=2H2O(g)△H=﹣483.6kJmol﹣1
C(s,石墨)+O2(g)=CO2(g)△H=﹣393.5kJmol﹣1
CO2(g)+C(s,石墨)=2CO(g)△H=+172.5kJmol﹣1
(1)请写出CO与水蒸汽反应的热化学方程式
(2)在一体积为10L的密闭容器中,通入一定量的CO和水蒸汽,在850℃时发生反应,容器中CO和水蒸汽浓度变化如图,则0~4min的平均反应速率v(CO)= , 请计算此时的平衡常数K= . 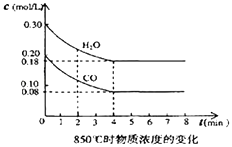
时间/min | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表.
①表中3min~4min之间反应处于状态;c1数值0.08mol/L (填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能是以下的原因(填字母),表中5min~6min之间数值发生变化,可能的原因是 . (填字母)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.