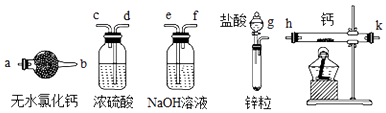
题目内容
【题目】常温时,Ksp[Mg(OH)2]=1.1×10﹣11 , Ksp(AgCl)=1.8×10﹣10 , Ksp(Ag2CrO4)=1.9×10﹣12Ksp(CH3COOAg)=2.3×10﹣3 , 下列叙述不正确的是( )
A.浓度均为0.2 molL﹣1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B.将0.001 molL﹣1的AgNO3溶液滴入0.001 molL﹣1的KCl和0.001 molL﹣1的K2CrO4的混合溶液中,先产生Ag2CrO4沉淀
C.c(Mg2+)为0.11 molL﹣1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上
D.在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变
【答案】B
【解析】解:A.等体积混合浓度均为0.1molL﹣1 , c(CH3COO﹣)×c(Ag+)=0.01>2.3×10﹣3 , 一定产生CH3COOAg沉淀,故A正确;
B.0.001 molL﹣1的KCl溶液中形成AgCl沉淀时,银离子的浓度为c(Ag+)= ![]() =1.8×10﹣7mol/L,0.001 molL﹣1的K2CrO4溶液中形成Ag2CrO4沉淀时,c(Ag+)=
=1.8×10﹣7mol/L,0.001 molL﹣1的K2CrO4溶液中形成Ag2CrO4沉淀时,c(Ag+)= ![]() =
= ![]() ×10﹣5mol/L,则KCl溶液中形成AgCl沉淀时银离子浓度小,即AgCl先达到饱和,应先生成AgCl沉淀,故B错误;
×10﹣5mol/L,则KCl溶液中形成AgCl沉淀时银离子浓度小,即AgCl先达到饱和,应先生成AgCl沉淀,故B错误;
C.Ksp〔Mg(OH)2〕=c(Mg2+)×c2(OH﹣),c(OH﹣)≥ ![]() =10﹣5 molL﹣1 , 溶液的pH至少要控制在9以上,故C正确;
=10﹣5 molL﹣1 , 溶液的pH至少要控制在9以上,故C正确;
D.Ksp(AgCl)只受温度的影响,与浓度无关,所以在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变,故D正确;
故选B.

 阅读快车系列答案
阅读快车系列答案【题目】已知:O2(g)+2H2(g)=2H2O(g)△H=﹣483.6kJmol﹣1
C(s,石墨)+O2(g)=CO2(g)△H=﹣393.5kJmol﹣1
CO2(g)+C(s,石墨)=2CO(g)△H=+172.5kJmol﹣1
(1)请写出CO与水蒸汽反应的热化学方程式
(2)在一体积为10L的密闭容器中,通入一定量的CO和水蒸汽,在850℃时发生反应,容器中CO和水蒸汽浓度变化如图,则0~4min的平均反应速率v(CO)= , 请计算此时的平衡常数K= . 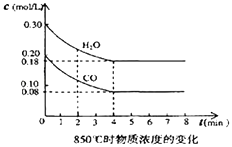
时间/min | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表.
①表中3min~4min之间反应处于状态;c1数值0.08mol/L (填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能是以下的原因(填字母),表中5min~6min之间数值发生变化,可能的原因是 . (填字母)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.