题目内容
20.氯水的成分中含有H2O,Cl2,HClO,H+,Cl-,ClO-等,这些微粒中,溶液呈淡黄绿色是含有Cl2(填微粒符号,下同),能与硝酸银溶液产生白色沉淀的是Cl-,具有漂白性的是HClO,能与碳酸钠溶液反应的是H+.分析 氯气溶于水发生反应Cl2+H2O?HCl+HClO,新制氯水含有Cl2、H2O、HClO、H+、Cl-等粒子,其中Cl2具有黄绿色,而Cl2、HClO具有强氧化性,HClO具有漂白性,溶液中含有Cl-可与硝酸银反应生成白色AgCl沉淀,其中H+可与碳酸钠溶液等物质反应,以此解答该题.
解答 解:氯气的颜色是黄绿色,溶液呈淡黄绿色是含有Cl2;
溶液中含有Cl-,Cl-可与硝酸银反应生成白色AgCl沉淀;
HClO具有漂白性,可使有色物质褪色,
其中H+可与碳酸钠溶液反应生成二氧化碳气体;
故答案为:Cl2;Cl-;HClO;H+.
点评 本题综合考查氯气和氯水的性质,注意把握氯气和水反应的特点以及氯水的成分和性质,为高考高频考点,侧重于基础知识的综合运用,难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
10.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.0mol/L的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 12g金刚石中含有碳酸键的个数为2NA | |
| C. | 25℃时1.0LpH=13的NaOH溶液中含有H+的数目为0.1NA | |
| D. | 1mol的甲基与1mol的铵银离子所含电子数均为10NA. |
11.下列说法不正确的是( )
| A. | 234U,235U,238U是不同的核素,互称同位素 | |
| B. | 陶瓷,玻璃,水晶,红宝石都属于硅酸盐 | |
| C. | Na与熔融的KCl反应能制取K,但不能证明Na的金属性比K强 | |
| D. | 在400℃,800个大气压下,钠能与二氧化碳生成钻石和石墨,反应过程中CO2被还原 |
8.下列有关电解质溶液的说法中正确的是( )
| A. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| B. | 25℃时,在 c(H+)=$\sqrt{{K}_{W}}$的溶液中,大量存在Na+、S2-、NO3-、CO32-等离子 | |
| C. | 常温,0.1mol•L-1的NaHSO3溶液的pH=6,则c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
5.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 mol•L-1NaClO溶液中含有的ClO-数目为NA | |
| B. | 常温常压下,11.2 L Cl2含氯原子数为NA | |
| C. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA | |
| D. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA |
9.下列有关化学用语表示正确的是( )
| A. | 水分子的比例模型: | B. | F-的结构示意图: | ||
| C. | H2O2的电子式: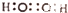 | D. | 葡萄糖的结构简式:C6H12O6 |
10.下列解释事实的方程式正确的是( )
| A. | 在空气中切开金属钠,光亮表面变暗:2Na+O2═Na2O2 | |
| B. | 向氯化铝溶液中加入过量氨水,产生白色沉淀:Al3++3OH-═Al(OH)3↓ | |
| C. | 将铁粉与水蒸气共热,产生气体:2Fe+3H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2 | |
| D. | 电解饱和氯化钠溶液,产生气体:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑ |
 .
.