题目内容
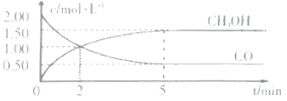
【题目】绝热容器中发生反应:3Z(s)![]() X(g)+2Y(g)△H=a kJ·mol-1(a>0)。下列说法不正确的是
X(g)+2Y(g)△H=a kJ·mol-1(a>0)。下列说法不正确的是
A.将0.3 mol Z置于容器中充分反应生成气体的物质的量一定小于0.3 mol
B.达到化学平衡状态时,气体平均摩尔质量不变
C.容器中放入3mol Z,达到化学平衡状态时,反应吸收的总热量为a kJ
D.容器温度不变,反应已经达到平衡
【答案】C
【解析】
A、可逆反应的反应物不会完全转化为产物,将0.3mol Z置于容器中充分反应生成气体的物质的量一定小于0.3mol,故A正确;
B、气体平均摩尔质量等于气体质量和物质的量的比值,反应气体质量和物质的量都变化,达到化学平衡状态时,气体平均摩尔质量不变,故B正确;
C、容器中放入3molZ,达到化学平衡状态时,消耗的Z的物质的量小于3mol,反应吸收的总热量小于akJ,故C错误;
D、反应伴随吸热,反应过程中会伴随温度的变化,变量不变的状态是平衡状态,容器温度不变,反应已经达到平衡,故D正确;
故选C。

练习册系列答案
相关题目