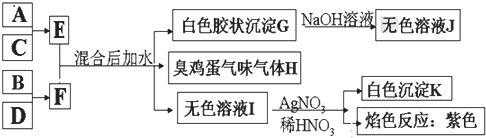
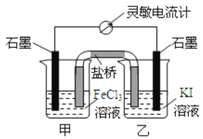
题目内容
【题目】已知N2(g)+3H2(g)![]() 2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
A.两个平衡状态的平衡常数的关系:KⅠ<KⅡ
B.H2的百分含量相同
C.N2的转化率:平衡I<平衡Ⅱ
D.反应放出的热量:QⅠ=QⅡ<92.3kJ
【答案】B
【解析】
已知N2(g)+3H2(g)![]() 2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,转化起始量为1molN2和3molH2,达到平衡状态II和平衡状态I相同;则
2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,转化起始量为1molN2和3molH2,达到平衡状态II和平衡状态I相同;则
A、平衡常数随温度变化,两个平衡状态的平衡常数的关系:KI=KII,故A错误;
B、平衡状态II和平衡状态I相同;H2的百分含量相同,故B正确;
C、平衡状态II和平衡状态I相同,N2的转化率:平衡I>平衡II,故C错误;
D、反应是可逆反应不能进行彻底,平衡Ⅱ反应是正逆进行,反应放出的热量:QI>QII都小于92.3 kJ,故D错误;
故选:B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目