题目内容
20.在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H=a kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )| A. | 若生成1 mol Fe,则吸收的热量小于a kJ | |
| B. | 若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 | |
| C. | 若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动 | |
| D. | 达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L |
分析 A、由热化学方程式可知,生成1molFe,吸收的热量等于akJ;
B、该反应前后气体的物质的量不变,恒温条件下,压强始终不变;
C、升高温度,正、逆反应速率都增大,平衡向吸热反应移动;
D、根据平衡常数计算判断.
解答 解:A、由热化学方程式可知,生成1molFe,吸收的热量等于akJ,故A错误;
B、该反应前后气体的物质的量不变,恒温条件下,压强始终不变,故压强不变,不能说明到达平衡,故B错误;
C、升高温度,正、逆反应速率都增大,该反应正反应是吸热反应,正反应速率增大更多,平衡向正反应移动,故C错误;
D、该温度下K=$\frac{c(CO{\;}_{2})}{c(CO)}$=0.263,若c(CO)=0.100mol/L,由平衡常数可知c(CO2)=0.1mol/L×0.263=0.0263mol/L,故D正确;
故选D.
点评 考查热化学方程式、化学平衡的影响因素、平衡状态的判断、平衡常数的有关计算等,难度中等,注意C选项中平衡状态的判断,选择判断的物理量随反应进行发生变化,当该物理量不再变化,说明到达平衡.

练习册系列答案
相关题目
10.下列化学用语的书写,正确的是( )
| A. | 氮气的电子式: | B. | 硫原子的结构示意图: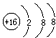 | ||
| C. | 溴化钠的电子式: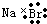 | D. | 水分子的结构式: |
8.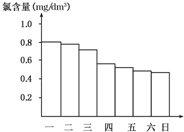 某校化学研究性学习小组对日常生活中的氯气的用途进行了调查,在调查某室外游泳池夏季池水消毒情况时,得知该游泳池每周一上午8:00换水,然后通入氯气消毒,如图是该小组每天19:00时测定的游泳池中水的含氯量,由此推测天气炎热、阳光强烈最可能的一天是( )
某校化学研究性学习小组对日常生活中的氯气的用途进行了调查,在调查某室外游泳池夏季池水消毒情况时,得知该游泳池每周一上午8:00换水,然后通入氯气消毒,如图是该小组每天19:00时测定的游泳池中水的含氯量,由此推测天气炎热、阳光强烈最可能的一天是( )
 某校化学研究性学习小组对日常生活中的氯气的用途进行了调查,在调查某室外游泳池夏季池水消毒情况时,得知该游泳池每周一上午8:00换水,然后通入氯气消毒,如图是该小组每天19:00时测定的游泳池中水的含氯量,由此推测天气炎热、阳光强烈最可能的一天是( )
某校化学研究性学习小组对日常生活中的氯气的用途进行了调查,在调查某室外游泳池夏季池水消毒情况时,得知该游泳池每周一上午8:00换水,然后通入氯气消毒,如图是该小组每天19:00时测定的游泳池中水的含氯量,由此推测天气炎热、阳光强烈最可能的一天是( )| A. | 周一 | B. | 周二 | C. | 周三 | D. | 周四 |
5.某有机物A的结构简式如图所示,它是一种营养增补剂,存在于槐树花蕾中,关于A的叙述不正确的是( )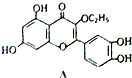

| A. | A的分子式为C17H14O7 | |
| B. | 一个A分子中含有三个苯环且A分子中无手性碳原子 | |
| C. | A可用有机溶剂萃取 | |
| D. | 1molA与足量的NaOH 溶液反应,最多可以消耗4molNaOH |
12.在相同的温度下,100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )
| A. | c(H+) | B. | 醋酸电离的程度 | ||
| C. | 中和时所需 NaOH的量 | D. | 醋酸的物质的量 |
9.下列叙述错误的是( )
| A. | 碱金属元素原子最外层都只有1个电子 | |
| B. | 依Li、Na、K、Rb,单质熔沸点升高,密度增大 | |
| C. | 单质氧化性:F2>Cl2>Br2>I2 | |
| D. | 氢化物稳定性:HF>HCl>HBr>HI |
10.某一化学反应在0.5L的密闭容器中,反应物B的物质的量在5s内从2.0mol变成0.5mol,在这5s内B的化学反应速率为( )
| A. | 3 mol/L | B. | 0.3molL/(L•s) | C. | 0.6 molL/(L•s) | D. | 0.1 molL/(L•s) |
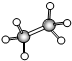 ;B的比例模型为
;B的比例模型为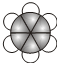 ;C是含氢量最大的有机物,分子结构为正四面体;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应.
;C是含氢量最大的有机物,分子结构为正四面体;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应. ,CCH4,DCH3CH2OH.
,CCH4,DCH3CH2OH.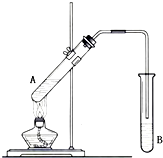 在试管A中加入2mL 乙醇,然后边振荡试管边慢慢加入3mL 浓硫酸和2mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯.
在试管A中加入2mL 乙醇,然后边振荡试管边慢慢加入3mL 浓硫酸和2mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯.