题目内容
5.某铝热剂由Fe3O4和Al组成.取a g该铝热剂样品,向其中加入足量的NaOH溶液,测得生成气体的体积为V1 L(标准状况,下同),反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.另取a g该样品将其引燃,恰好完全反应,待反应产物冷却后,加入足量盐酸,测得生成的气体的体积为V2 L.则V1:V2=3:2.分析 铝热剂中只有Al和氢氧化钠反应,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝热剂发生反应2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,反应后的物质中只有Fe和稀盐酸反应生成氢气,根据铝热反应知,Al和Fe的物质的量之比为1:1,根据转移电子计算生成气体体积之比.
解答 解:铝热剂中只有Al和氢氧化钠反应,反应离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,铝热剂发生反应2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,反应后的物质中只有Fe和稀盐酸反应生成氢气,根据铝热反应知,Al和Fe的物质的量之比为1:1,假设Al、Fe的物质的量都是2mol,2molAl在反应中转移6mol电子、2molFe在反应中转移4mol电子,所以2molAl和NaOH完全反应生成3mol氢气、2molFe和稀盐酸反应生成2mol氢气,根据V=nVm知,相同条件下生成氢气体积之比等于氢气的物质的量之比=3mol:2mol=3:2,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑,3:2.
点评 本题考查混合物的计算,侧重考查学生分析计算能力,利用转移电子进行计算能化繁为简,提高解题效率,还可以根据方程式进行计算,题目难度不大.

练习册系列答案
相关题目
15.下列有关化学用语表示不正确的是( )
| A. | 甲酸乙酯的结构简式:HCOOCH2CH3 | |
| B. | 质子数为53,中子数为75的碘原子:${\;}_{53}^{128}$I | |
| C. | 四氯化碳的电子式: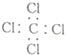 | |
| D. | 间甲基苯酚: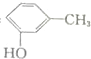 |
13.海带中含丰富的碘元素,从海带中分离出碘可按如下步骤进行:①滴加稀硫酸酸化后,加入适量H2O2(质量分数为3%) ②将海带焙烧成灰后加水搅拌 ③加CCl4振荡 ④用分液漏斗分液 ⑤煮沸、过滤.合理的操作顺序是( )
| A. | ①②③④⑤ | B. | ①③⑤②④ | C. | ②⑤①③④ | D. | ②①③⑤④ |
20.为达到下列实验目的,所选试剂不足的是( )
| 选项 | 实验目的 | 选用试剂 |
| A | 探究Cl2、Br2、I2的氧化性强弱顺序 | 氯水、溴水、KI溶液 |
| B | 探究化学反应的能量变化 | Ba(OH)2•8H2O、NH4Cl晶体 |
| C | 证明海带灰中含有碘元素 | 海带灰、稀硫酸、3%的H2O2溶液、淀粉溶液 |
| D | 证明淀粉是否水解 | 淀粉溶液、稀硫酸、NaOH溶液、银氨溶液 |
| A. | A | B. | B | C. | C | D. | D |
10.下列化学用语的书写,正确的是( )
| A. | 氮气的电子式: | B. | 硫原子的结构示意图: | ||
| C. | 溴化钠的电子式: | D. | 水分子的结构式: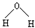 |
17.下列有关铵盐的叙述中,不正确的是( )
| A. | 铵盐都易溶于水 | |
| B. | 由于易溶,Na+、K+、NH4+都不可能在相关离子方程式中出现 | |
| C. | NH4Cl的分解与NH3、HCl的化合不属于可逆反应 | |
| D. | 铵盐都能与NaOH反应 |
14. 短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )
 短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )| A. | W的非金属元素比Z的弱 | |
| B. | W的最高价氧化物对应的水化物是强酸 | |
| C. | Y的原子半径在同周期主族元素中最大 | |
| D. | Z的气态氢化物的稳定性在同主族元素中最强 |
 在试管A中加入2mL 乙醇,然后边振荡试管边慢慢加入3mL 浓硫酸和2mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯.
在试管A中加入2mL 乙醇,然后边振荡试管边慢慢加入3mL 浓硫酸和2mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯.