题目内容
6.如图,X、Y、Z、M、N是元素周期表中前四周期中的五种元素,其中M原子的最外层电子数比次外层电子数多4.下列说法不正确的是( )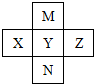
| A. | M形成的氢化物有2种 | |
| B. | M、Y、N的气态氢化物稳定性依次减弱 | |
| C. | X、Y、Z的含氧酸酸性依次增强 | |
| D. | Y的一种氧化物是大气污染物,是形成酸雨的主要物质 |
分析 M原子的最外层电子数比次外层电子数多4,原子只能有2个电子层,最外层电子数为6,故M为O元素;由元素在周期表中位置可知,X为P元素、Y为S元素、Z为Cl、N为Se,据此解答.
解答 解:M原子的最外层电子数比次外层电子数多4,原子只能有2个电子层,最外层电子数为6,故M为O元素;由元素在周期表中位置可知,X为P元素、Y为S元素、Z为Cl、N为Se.
A.M形成的氢化物有水、过氧化氢2种,故A正确;
B.非金属性M>Y>N,故它们气态氢化物稳定性依次减弱,故B正确;
C.X、Y、Z的非金属性依次增强,它们最高价含氧酸酸性依次增强,不是最高价含氧酸,则不一定,如HClO为弱酸,而硫酸为强酸,故C错误;
D.二氧化硫是大气污染物,是形成酸雨的主要物质,故D正确,
故选C.
点评 本题考查结构性质位置关系应用,需要学生熟练掌握元素周期表的结构,注意对元素周期律的理解应用,难度不大.

练习册系列答案
相关题目
17.下列有关铵盐的叙述中,不正确的是( )
| A. | 铵盐都易溶于水 | |
| B. | 由于易溶,Na+、K+、NH4+都不可能在相关离子方程式中出现 | |
| C. | NH4Cl的分解与NH3、HCl的化合不属于可逆反应 | |
| D. | 铵盐都能与NaOH反应 |
14. 短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )
 短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )| A. | W的非金属元素比Z的弱 | |
| B. | W的最高价氧化物对应的水化物是强酸 | |
| C. | Y的原子半径在同周期主族元素中最大 | |
| D. | Z的气态氢化物的稳定性在同主族元素中最强 |
1.下列措施能减慢H2O2分解速率,有利于双氧水长时间保存的是( )
| A. | 放在无色透明细口瓶中 | B. | 置于冷暗处 | ||
| C. | 置于通风透光处 | D. | 加入少量MnO2或FeCl3溶液 |
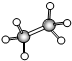 ;B的比例模型为
;B的比例模型为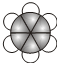 ;C是含氢量最大的有机物,分子结构为正四面体;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应.
;C是含氢量最大的有机物,分子结构为正四面体;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应. ,CCH4,DCH3CH2OH.
,CCH4,DCH3CH2OH.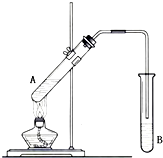 在试管A中加入2mL 乙醇,然后边振荡试管边慢慢加入3mL 浓硫酸和2mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯.
在试管A中加入2mL 乙醇,然后边振荡试管边慢慢加入3mL 浓硫酸和2mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯. (用电子式表示).
(用电子式表示).