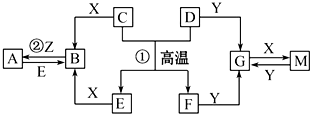
题目内容
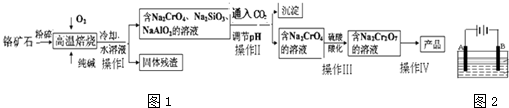
2.实验室模拟合成氨和氨催化氧化的流程如下:
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
(1)从图1中选择制取气体的合适装置:氮气a、氢气b.
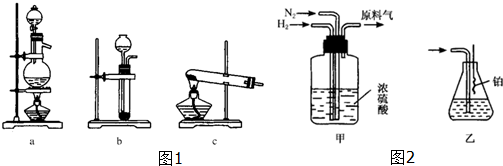
(2)氮气和氢气通过图2甲装置,甲装置的作用除了将气体混合外,还有干燥气体 控制氢气和氮气的流速、.
(3)氨合成器出来经冷却的气体连续通入图2乙装置的水中吸收氨,不会(填“会”或“不会”)发生倒吸,原因是混合气体中含有大量难溶于水的氮气、氢气两种气体.
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热,锥形瓶中还可观察到的现象是有红棕色气体产生.
(5)写出乙装置中氨氧化的化学方程式:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O.
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、NH4+、NO3-.
分析 (1)依据反应物状态和反应条件选择合适的发生装置;
(2)浓硫酸具有吸水性,通过观察图2甲装置中冒气泡的速率来控制气体流量;
(3)合成氨的反应是可逆的,还会有一些氮气、氢气存在,据此来回答;
(4)氨气催化氧化生成一氧化氮,一氧化氮氧化生成红棕色二氧化氮;
(5)氨气催化氧化生成一氧化氮和水;
(6)锥形瓶内氮的氧化物与水反应生成硝酸,硝酸再与氨水反应生成硝酸铵.
解答 解:(1)实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,所以应选择a装置;
制取氢气用稀盐酸与锌不需要加热,所以应选择装置b;
故答案为:a;b;
(2)浓硫酸具有吸水性,氮气和氢气通过甲装置,图2甲装置中的浓硫酸可以将氮气和氢气干燥,同时可以根据甲装置中冒气泡的速率来控制气体流量,
故答案为:干燥气体;控制氢气和氮气的流速;
(3)合成氨的反应为为可逆反应,还会有一些氮气、氢气存在,这样会缓解氨气极易溶于水导致的气压差,不会倒吸,故答案为:不会;因为混合气体中含有大量难溶于水的氮气、氢气两种气体;
(4)氨催化氧化产物一氧化氮极易变为二氧化氮,二氧化氮是红棕色气体,故答案为:有红棕色气体产生;
(5)氨气催化氧化生成一氧化氮和水,方程式;4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
(6)锥形瓶内氮的氧化物与水反应生成硝酸,硝酸再与氨水反应生成硝酸铵.所以锥形瓶内溶液含有硝酸铵,所以溶液中含有H+、OH-、NH4+、NO3-离子;
故答案为:NH4+;NO3-.
点评 本题为信息题,考查了氮气、氢气、氨气的制备,熟悉反应原理是解题关键,注意依据反应物状态和反应条件选择合适的发生装置,题目难度不大.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | CO32-、H+、HCO3-、Ca2+ | B. | NH4+、OH-、Ba2+、NO3- | ||
| C. | I-、ClO-、NO3-、H+ | D. | SO32-、SO42-、Na+、OH- |
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多 |
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3.
| A. | ③④ | B. | ①②③④ | C. | ①③④ | D. | ①②⑤ |
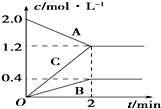 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答: