题目内容
3.下列各原子或离子的电子排布式错误的为( )| A. | Na+ 1s22s22p6 | B. | F- 1s22s22p6 | ||
| C. | N3- 1s22s22p3 | D. | O 1s22s22p4 |
分析 原子或离子的电子排布应符合能量最低原理,一般来说离子的核外最外层达到8电子稳定结构,根据构造原理,s能级最多可容纳2个电子,p能级有3个轨道最多可容纳6个电子,电子总是优先从能量低的能层、能级排列,以此判断.
解答 解:A.Na的原子序数为11,离子的核外电子排布式为1s22s22p6,最外层达到8电子稳定结构,故A正确;
B.F原子核外有9个电子,离子的核外电子排布式为1s22s22p6,最外层达到8电子稳定结构,故B正确;
C.N的原子序数为8,离子的核外电子排布式为1s22s22p6,故C错误;
D.O的原子序数为8,离子的核外电子排布式为1s22s22p6,最外层应达到8电子稳定结构,故D正确.
故选C.
点评 本题考查的是构造原理及各能级最多容纳的电子数,题目难度不大,注意把握原子核外电子排布规律.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列说法正确的是( )
| A. | 化学反应不一定有分子碰撞 | B. | 发生有效碰撞的分子是活化分子 | ||
| C. | 具有较高能量的分子是活化分子 | D. | 化学反应的活化能一定大于零 |
18.已知某溶液中可能含有NH4+、SO32-、SO42-、NO3-及其它某些未知离子,某学生取适量试液放入试管中,然后进行如下实验并得出相应的结论,其中合理的是( )
| A. | 加入BaCl2溶液得到白色,过滤并洗涤沉淀,然后将沉淀加入到足量的稀硝酸中,沉淀无任何变化,说明该溶液中一定含有SO42- | |
| B. | 加入BaCl2溶液得到白色,过滤并洗涤沉淀,然后将沉淀加入到足量的稀盐酸中,沉淀溶解并产生刺激性气味的气体,说明该溶液中一定含有SO32- | |
| C. | 加入1mL0.2mol/L的NaOH,将湿润的紫色石蕊试纸靠近试管口,试纸无变化,说明溶液中一定无NH4+ | |
| D. | 加入锌片后无变化,再加入适量的稀硫酸,锌片溶解并有气泡产生,该溶液中一定含有NO3- |
8.把下列四种X溶液分别加入四个盛有10mL 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸和缓地进行反应.其中反应速率最大的是( )
| A. | 20mL 3mol/L 的X溶液 | B. | 20mL 2mol/L 的X溶液 | ||
| C. | 10mL 4mol/L的X溶液 | D. | 10mL 2mol/L的X溶液 |
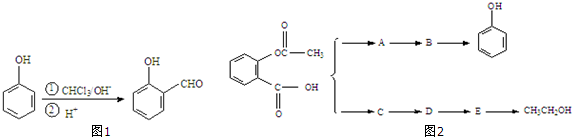
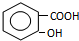 ,B
,B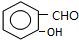 ,C
,C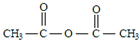 ,DCH3COOH,ECH3CHO.
,DCH3COOH,ECH3CHO.
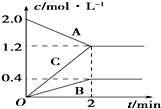 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答: