题目内容
【题目】现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第3周期元素的简单离子中半径最小 |
(1)元素T在元素周期表中的位置是________。
(2)元素Y与元素Z相比,金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______(填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
(3)上述四种元素中有2种元素能形成一种淡黄色的固体,该化合物的电子式是________,所含化学键的类型有________。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素形成的化合物W气态时的密度与氧气相等(同温同压),Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式________。
【答案】 第2周期VIA族 Na c d ![]() 离子键、共价键(或非极性键) N2H4 + 2H2O2=N2↑ + 4H2O
离子键、共价键(或非极性键) N2H4 + 2H2O2=N2↑ + 4H2O
【解析】T元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则T为O元素;常温下X的单质为双原子分子,分子中含有3对共用电子对,则X为N元素;Y元素原子M层比K层少1个电子,则M才电子数为1,Y为Na;第三周期元素的简单离子中Z的半径最小,则Z为Al,据此解答。
T元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则T为O元素;常温下X的单质为双原子分子,分子中含有3对共用电子对,则X为N元素;Y元素原子M层比K层少1个电子,则M才电子数为1,Y为Na;第三周期元素的简单离子中Z的半径最小,则Z为Al,(1)元素T为氧元素,在元素周期表中的位置是第2周期VIA族;(2)Na、Al同周期,随原子序数增大,金属性减弱,故Na的金属性较强;a.单质的熔点属于物理性质,不能比较金属性强弱,选项a错误;c.Na单质与水反应比Al单质剧烈,说明Na金属性更强,选项c正确;b.金属性强弱与失去电子难易有关,与失去电子数目多少无关,即与化合价高低无关,选项b错误;d.Na最高价氧化物的水化物的碱性比Al强,说明钠的金属性更强,选项d正确,答案选cd;(3)上述四种元素中有2种元素能形成一种淡黄色的固体,该化合物为过氧化钠,其电子式是![]() ,所含化学键的类型有离子键、共价键(或非极性键);(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,为H2O2,元素X与氢元素形成的化合物W气态时的密度与氧气相等(同温同压)则相对分子质量为32,为N2H4,H2O2与N2H4发生氧化还原反应,生成X单质N2和T的另一种氢化物H2O,该反应的化学方程式为N2H4 +2H2O2=N2↑+4H2O。
,所含化学键的类型有离子键、共价键(或非极性键);(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,为H2O2,元素X与氢元素形成的化合物W气态时的密度与氧气相等(同温同压)则相对分子质量为32,为N2H4,H2O2与N2H4发生氧化还原反应,生成X单质N2和T的另一种氢化物H2O,该反应的化学方程式为N2H4 +2H2O2=N2↑+4H2O。

 千里马走向假期期末仿真试卷寒假系列答案
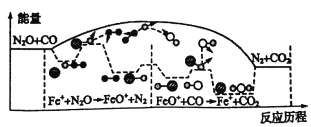
千里马走向假期期末仿真试卷寒假系列答案【题目】碳和氮是地球上含量丰富的两种元素。其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响。
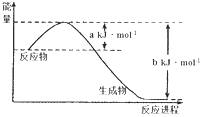
(1)下图是25℃,101kPa时,1molNO2气体和1molCO反应生成CO2和NO过程中能量变化示意图。写出该反应的热化学方程式____________________________________。
(2)在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s)![]() N2(g)+CO2(g),达到平衡时的数据如下:
N2(g)+CO2(g),达到平衡时的数据如下:
温度 | n(C)/mol | n(CO2)/mol |
T1 | 0.3 | |
T2 | 0.6 |
请回答下列问题:
①T1℃时,该反应的平衡常数K=___________。
②T2℃时,下列能判断该反应达到平衡状态的是___________(填序号)。
A.v(CO2)正=2v(NO)逆 B.混合气体的平均相对分子质量不再变化
C.混合气体的密度不再变化 D.N2、CO2的物质的量之比不再变化
③T2℃时,若达平衡后再充入0.4molNO和0.3molCO2,平衡向___________(填“正向”“逆向“或“不”)移动。
④若△H<O,则T1___________T2(填“>”或“<”)。
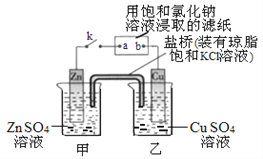
(3)电解法处理含氮氧化物废气,可回收硝酸。实验室模拟电解法吸收NOx的装置如右图所示:

①若用NO2气体进行模拟电解法吸收实验,写出NO2发生反应的电极反应式________________。
②若有标况下2.24LNO被吸收,通过阳离子交换膜的H+为___________mol。