题目内容
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是
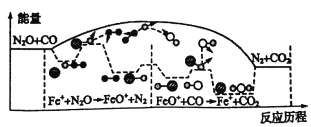
A. 反应总过程△H<0
B. Fe+使反应的活化能减小
C. 总反应若在2L的密闭容器中进行,温度越高反应速率一定越快
D. Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步反应均为放热及应
【答案】C
【解析】A、反应物的总能量高生成物的总能量,则反应是放热反应,所以反应的△H<0,故A正确;B、Fe+是催化剂,降低该反应的活化能,所以Fe+使该反应的活化能减小,故B正确;C、该反应的总反应为N2O+CO= N2+CO2,反应过程中使用了催化剂,催化剂的活性与温度有关,只有在适当的温度范围内才能发挥催化剂的催化活性,因此温度越高,反应速率不一定越快,故C错误;D、由图可知Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步反应,都是反应物的总能高于生成物的总能量,所以两步反应均为放热反应,故D正确;故选C。

【题目】现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第3周期元素的简单离子中半径最小 |
(1)元素T在元素周期表中的位置是________。
(2)元素Y与元素Z相比,金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______(填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
(3)上述四种元素中有2种元素能形成一种淡黄色的固体,该化合物的电子式是________,所含化学键的类型有________。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素形成的化合物W气态时的密度与氧气相等(同温同压),Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式________。
【题目】某小组研究铁与水蒸气的反应,两位同学分别进行了如下实验。
实验Ⅰ | 实验Ⅱ |
|
|
请回答:
(1)实验Ⅰ中湿棉花的作用是______________。
(2)实验Ⅰ中反应的化学方程式是__________。
(3)甲同学观察到实验Ⅰ中持续产生肥皂泡,实验Ⅱ中溶液B呈现红色。说明溶液A中含有___________。
(4)乙同学观察到实验Ⅰ中持续产生肥皂泡,但实验Ⅱ中溶液B未呈现红色。溶液B未呈现红色的原因是____________。