题目内容
【题目】碳和氮是地球上含量丰富的两种元素。其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响。
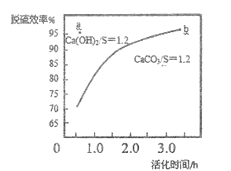
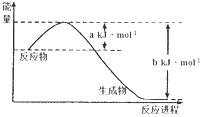
(1)下图是25℃,101kPa时,1molNO2气体和1molCO反应生成CO2和NO过程中能量变化示意图。写出该反应的热化学方程式____________________________________。
(2)在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s)![]() N2(g)+CO2(g),达到平衡时的数据如下:
N2(g)+CO2(g),达到平衡时的数据如下:
温度 | n(C)/mol | n(CO2)/mol |
T1 | 0.3 | |
T2 | 0.6 |
请回答下列问题:
①T1℃时,该反应的平衡常数K=___________。
②T2℃时,下列能判断该反应达到平衡状态的是___________(填序号)。
A.v(CO2)正=2v(NO)逆 B.混合气体的平均相对分子质量不再变化
C.混合气体的密度不再变化 D.N2、CO2的物质的量之比不再变化
③T2℃时,若达平衡后再充入0.4molNO和0.3molCO2,平衡向___________(填“正向”“逆向“或“不”)移动。
④若△H<O,则T1___________T2(填“>”或“<”)。
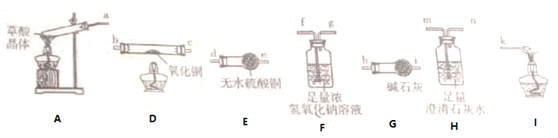
(3)电解法处理含氮氧化物废气,可回收硝酸。实验室模拟电解法吸收NOx的装置如右图所示:
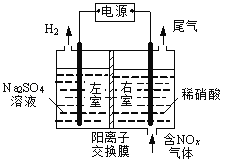
①若用NO2气体进行模拟电解法吸收实验,写出NO2发生反应的电极反应式________________。
②若有标况下2.24LNO被吸收,通过阳离子交换膜的H+为___________mol。
【答案】 NO2(g)+CO(g)=CO2(g)+NO(g)△H=-(b-a)kJ/mol ![]() BC 正向 > NO2-e-+H2O=NO3-+2H+ 0.3
BC 正向 > NO2-e-+H2O=NO3-+2H+ 0.3
【解析】(1)根据图可知,该反应为放热反应,焓变△H=(+a-b)kJ/mol,热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g)△H=-(b-a)kJ/mol;
(2)①根据已知条件,列出T1℃时反应的三段式:

容器体积为2L,平衡时c(NO)=0.2mol/L,c(N2)=c(CO2)=0.15mol/L,则K=![]() =
=![]() 。
。
②变量不变则平衡。A、当v(CO2)正∶v(NO)逆=1∶2,即2v(CO2)正=v(NO)逆时,反应达到平衡状态,故A错误;B、混合气体的平均相对分子质量=气体的质量÷气体的物质的量,由于气体的质量是变量,物质的量不是变量,故平均相对分子质量为变量,变量不变达平衡,故B正确;C、混合气体的密度为变量,变量不再改变则平衡,故C正确;D、无论平衡与否,N2、CO2的物质的量之比一直是1∶1,不能作为平衡的标志,故D错误。故选BC。
③T2℃平衡时,容器中碳的物质的量为0.6mol,列出平衡三段式:
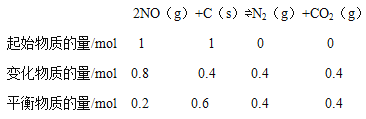
容器体积为2L,平衡时c(NO)=0.1mol/L,c(N2)=c(CO2)=0.2mol/L,则T2℃时,K=![]() =4;再充入0.4molNO和0.3molCO2,瞬间c(NO)=(0.2+0.1)÷2=0.2mol/L,c(CO2)= (0.4+0.3)÷2=0.35mol/L,c(N2)=0.2mol/L,则Qc=
=4;再充入0.4molNO和0.3molCO2,瞬间c(NO)=(0.2+0.1)÷2=0.2mol/L,c(CO2)= (0.4+0.3)÷2=0.35mol/L,c(N2)=0.2mol/L,则Qc=![]() =
=![]() <K2,反应正向进行。
<K2,反应正向进行。
④T1℃时,K=![]() ,T2℃时,K2=4;又△H<O,正反应为放热反应,升高温度,平衡常数减小,则T1>T2;
,T2℃时,K2=4;又△H<O,正反应为放热反应,升高温度,平衡常数减小,则T1>T2;
(3)①根据图知,电解时,左室电极上产生H2,则左边电极为水电离出的H+放电,左室为阴极室,右室为阳极室。该装置可以回收硝酸,阳极上通入的是NOx,则阳极上NOx,失电子生成硝酸;NO2放电的电极反应为NO2-e-+H2O=NO3-+2H+;
②标况下2.24LNO为0.1molNO,NO放电的阳极反应式为NO-3e-+2H2O=NO3-+4H+,有0.4mol H+、0.1mol NO3-生成,根据溶液电中性原理,应有0.3mol H+通过阳离子交换膜进入阴极室,故答案为:0.3。

【题目】现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第3周期元素的简单离子中半径最小 |
(1)元素T在元素周期表中的位置是________。
(2)元素Y与元素Z相比,金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______(填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
(3)上述四种元素中有2种元素能形成一种淡黄色的固体,该化合物的电子式是________,所含化学键的类型有________。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素形成的化合物W气态时的密度与氧气相等(同温同压),Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式________。