题目内容
【题目】将下图所示实验装置的K闭合,下列判断正确的是
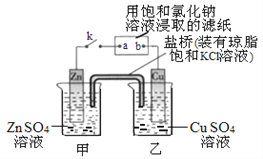
A. Zn电极上发生还原反应
B. 片刻后盐桥中的Cl-向乙装置中移动
C. 当电路中有0.2mol电子转移时,甲池增重质量为6.5克
D. 电子的流动方向从Zn→a ; b→Cu
【答案】D
【解析】A.由图可知,K闭合时,甲、乙构成原电池,Zn为负极,失去电子发生氧化反应,故A错误;B.原电池中,阴离子向负极移动,因此盐桥中Cl-离子向甲移动,故B错误;C.当电路中有0.2mol电子转移时,甲池中溶解的锌为0.1mol,质量为6.5克,盐桥中有0.2mol氯离子进入甲池中,甲池增重质量为6.5g+7.1g,故C错误;D.电子由负极流向正极,电子不能进入溶液中,则电子沿Zn→a,b→Cu路径流动,故D正确;故选D。

【题目】现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第3周期元素的简单离子中半径最小 |
(1)元素T在元素周期表中的位置是________。
(2)元素Y与元素Z相比,金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______(填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
(3)上述四种元素中有2种元素能形成一种淡黄色的固体,该化合物的电子式是________,所含化学键的类型有________。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素形成的化合物W气态时的密度与氧气相等(同温同压),Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式________。
【题目】某小组研究铁与水蒸气的反应,两位同学分别进行了如下实验。
实验Ⅰ | 实验Ⅱ |
|
|
请回答:
(1)实验Ⅰ中湿棉花的作用是______________。
(2)实验Ⅰ中反应的化学方程式是__________。
(3)甲同学观察到实验Ⅰ中持续产生肥皂泡,实验Ⅱ中溶液B呈现红色。说明溶液A中含有___________。
(4)乙同学观察到实验Ⅰ中持续产生肥皂泡,但实验Ⅱ中溶液B未呈现红色。溶液B未呈现红色的原因是____________。


