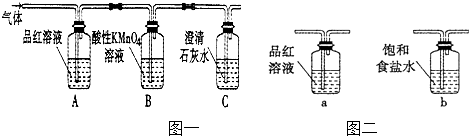
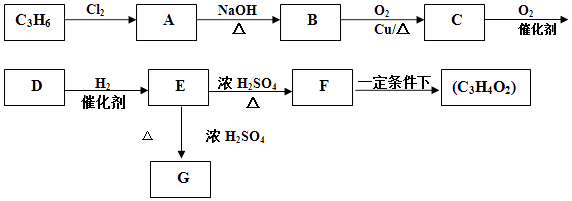
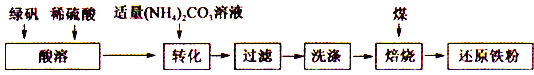
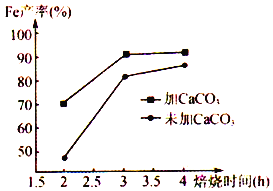
题目内容
【题目】把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:3A (g)+B(g)2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(Lmin),下列说法错误的是( )
A.x=2
B.B的转化率为20%
C.平衡时A的浓度为0.75mol/L
D.恒温达平衡时容器内的压强为开始时的85%
【答案】D
【解析】平衡时生成C为2mol,D的平均反应速率为0.1mol/(Lmin),生成D的物质的量为0.1mol/(Lmin)×5min×4L=2mol,则:
3A(g)+ | B(g) | 2C(g)+ | xD(g) | |
起始(mol) | 6 | 5 | 0 | 0 |
转化(mol) | 3 | 1 | 2 | 2 |
平衡(mol) | 3 | 4 | 2 | 2 |
A.物质的量之比等于化学计量数之比,故2:2=1:x,则x=2,故A不符合题意;
B.B的转化率为= ![]() =20%,故B不符合题意;
=20%,故B不符合题意;
C.平衡时A的浓度= ![]() =0.75mol/L,故C不符合题意;
=0.75mol/L,故C不符合题意;
D. 反应前后气体的物质的量不变,恒温恒容下,压强之比等于物质的量之比,平衡时容器内的压强与开始时压强相等,故D符合题意,
所以答案是:D.
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

 寒假学与练系列答案
寒假学与练系列答案【题目】现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第3周期元素的简单离子中半径最小 |
(1)元素T在元素周期表中的位置是________。
(2)元素Y与元素Z相比,金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______(填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
(3)上述四种元素中有2种元素能形成一种淡黄色的固体,该化合物的电子式是________,所含化学键的类型有________。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素形成的化合物W气态时的密度与氧气相等(同温同压),Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式________。