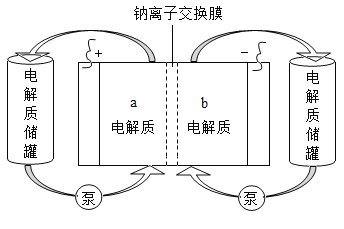
��Ŀ����
����Ŀ��ˮ�ĵ���ƽ��������ͼ��ʾ��

��1������A���ʾ25��ʱˮ�ڵ���ƽ��ʱ������Ũ�ȣ� ���¶�����100��ʱ��ˮ�ĵ���ƽ��״̬��B�㣬���ʱˮ�����ӻ���_____________���ӵ�_____________��
��2������100���ĺ��£���pH=8��Ba(OH)2��Һ��pH=5��ϡ�����ϣ���ʹ�����ҺpH=7����Ba(OH)2������������Ϊ____________________��
��3�����ʵ���Ũ����ͬ�Ĵ��������������Һ��Ϻ���Һ�д�������Ӻ�������Ũ����ȣ����Ϻ���Һ��________�������������������������������������������____________����������Һ����������� >�� ������������<�� ����
��4����֪ij��Һ��ֻ����OH-��H+��NH4+��Cl-�������ӣ�ijͬѧ�Ʋ����Һ�и�����Ũ�ȴ�С˳��������������ֹ�ϵ��
A��c(Cl-)��c(NH4+)��c(H+)��c(OH-) B��c(Cl-)��c(NH4+)��c(OH-)��c(H+)
C��c(Cl-)��c(H+)��c(NH4+)��c(OH-) D��c(NH4+)��c(Cl-)��c(OH-)��c(H+)
������Һ��ֻ�ܽ���һ�����ʣ���������Ũ�ȴ�С��ϵ����ȷ���ǣ�ѡ����ĸ��________��
����������ϵ��D����ȷ�ģ�����Һ�е�����Ϊ____________________��
������ˮ�м���ϡ��������Һ��pH=7����ʱc(NH4+)=a mol/L����c(SO42-)= _____
���𰸡�10��14 10��12 2��9 ���� �� A NH3��H2O��NH4Cl a/2mol/L
��������
(1)A��25�棬c(H+)=c(OH-)=1��10-7mol/L��Kw=c(H+)c(OH-)=1��10-7��1��10-7=10-14��
100��ʱ��c(H+)=c(OH-)=1��10-6mol/L��Kw=c(H+)c(OH-)=1��10-6��1��10-6=10-12��
�ʴ�Ϊ��10-14��10-12��
(2)��pH=8��Ba(OH)2��Һ��c(OH-)=10-4 mol/L��pH=5��ϡ������c(H+)=10-5 mol/L�����������������Ϊx����������Ϊy�������Һ��pH=7����Һ�ʼ��ԣ�c(OH-)=![]() =10-5 mol/L��c(OH-)=
=10-5 mol/L��c(OH-)=![]() =10-5 mol/L����� x��y=2��9���ʴ�Ϊ��2��9��
=10-5 mol/L����� x��y=2��9���ʴ�Ϊ��2��9��
(3)���ʵ���Ũ����ͬ�Ĵ��������������Һ��Ϻ���Һ��c(Na+)=c(CH3COO-)�����ݵ���غ���c(H+)=c(OH-)����Һ�����ԣ���������Һ�ʼ��ԣ�Ҫʹ�����NaOH�����Һ�����ԣ�����Ӧ�������������Դ��������NaOH��Һ������ʴ�Ϊ�У����ԣ�����
(4)�����κ�ˮ��Һ�ж���OH-��H+��������ֻ��һ����ΪNH4Cl��笠�����ˮ�ⷽ��ʽΪNH4++H2ONH3��H2O+H+����c(Cl-)��c(NH4+)��ˮ�����Һ�����ԣ���c(H+)��c(OH-)����ˮ��ij̶Ⱥ�������c(Cl-)��c(NH4+)��c(H+)��c(OH-)����A���ϣ��ʴ�Ϊ��A��
����������ϵ��D����ȷ�ģ���Һ�ʼ��ԣ���c(NH4+)��c(Cl-)��ӦΪNH3H2O��NH4Cl�Ļ����ʴ�Ϊ��NH3H2O��NH4Cl��
�ۻ����Һ�����ԣ�����c(H+)=c(OH-)�����ݵ���غ��c(NH4+)+c(H+)=2c(SO42-)+c(OH-)������c(SO42-)=![]() c(NH4+)=
c(NH4+)=![]() amolL-1���ʴ�Ϊ��
amolL-1���ʴ�Ϊ��![]() amolL-1��
amolL-1��

����Ŀ��25 ��ʱ���������ʵĵ��볣�������ʾ��
��ѧʽ | CH3COOH | H2CO3 | HClO |
���볣�� | 1.7��10-5 | K1��4.3��10-7 K2��5.6��10-11 | 3.0��10-8 |
��ش��������⣺
(1)CH3COOH��H2CO3��HClO��������ǿ������˳��Ϊ______________________����д��NaHCO3��Һ�Լ��Եĵ����ӷ���ʽ________��
(2)ͬŨ�ȵ�CH3COO-��HCO3-��CO32-��ClO-���H+��������ǿ������˳��Ϊ______________��
(3)�����ͬ��pH��ͬ��CH3COOH��Һ��HClO��Һ����NaOH��Һ�к�ʱ��������NaOH�����ʵ���________(����ĸ)��
A����ͬ B���к�CH3COOH�Ķ�
C���к�HClO�Ķ� D�����Ƚ�
(4)���Ϊ10 mL pH��2�Ĵ�����Һ��һԪ��HX��Һ�ֱ��ˮ ϡ����1 000 mL��ϡ����pH�仯��ͼ��ʾ����HX�ĵ��볣�� ________(����������������������С����)����ĵ��볣����

(5)H��Ũ����ͬ�������������ҺA(����)��B(CH3COOH)�ֱ���п�۷�Ӧ����������һ����Һ�д���п���ų�������������ͬ��������˵����ȷ����______ (��д���)��
�ٷ�Ӧ����Ҫ��ʱ��B��A���ڿ�ʼ��Ӧʱ������A��B �۲μӷ�Ӧ��п�����ʵ���A��B��
�ܷ�Ӧ���̵�ƽ������B��A����A����пʣ�ࡡ��B����пʣ��
����Ŀ����ȩ��ľ�ļӹ���ҽҩ�ȷ�������Ҫ��;���״�ֱ�������ǹ�ҵ�Ϻϳɼ�ȩ���·������Ʊ������漰����Ҫ��Ӧ���£�
��ӦI��CH3OH(g)![]() HCHO(g)+H2(g) ��H1=+85.2kJ��mol��1
HCHO(g)+H2(g) ��H1=+85.2kJ��mol��1
��ӦII��CH3OH(g)+1/2O2(1)![]() HCHO(g)+H2O(g) ��H2
HCHO(g)+H2O(g) ��H2
��ӦIII��H2(g)+1/2O2(g)![]() H2O(g) ��H3=��241.8kJ��mol��1
H2O(g) ��H3=��241.8kJ��mol��1
����Ӧ��
��ӦIV��CH3OH(g)+O2(g)![]() CO(g)+2H2O(g) ��H4=��393.0kJ��mol��1
CO(g)+2H2O(g) ��H4=��393.0kJ��mol��1
��1�����㷴Ӧ���ķ�Ӧ����H2=____________________________________________��
��2��750K�£��ں����ܱ������У�������ӦCH3OH(g)![]() HCHO(g)+H2(g��������ʼѹǿΪP0���ﵽƽ��ת����Ϊ������ƽ��ʱ����ѹǿPƽ=___________(�ú�P0������ʽ�ӱ�ʾ)����P0=101kPa�������=50.0%�����㷴Ӧƽ�ⳣ��Kp=___________kPa(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������������Ӧ)��
HCHO(g)+H2(g��������ʼѹǿΪP0���ﵽƽ��ת����Ϊ������ƽ��ʱ����ѹǿPƽ=___________(�ú�P0������ʽ�ӱ�ʾ)����P0=101kPa�������=50.0%�����㷴Ӧƽ�ⳣ��Kp=___________kPa(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������������Ӧ)��
��3��Na2CO3�Ǽ״������Ƽ�ȩ�Ĵ��������о�ָ��������Ӧ�IJ��ֻ������£�
����i��CH3OH��H+��CH2OH
����������CH2OH����H+HCHO
����������CH2OH��3��H+CO
����iv����H+��H��H2
��ͼ��ʾһ���������¶ȶ�̼���ƴ��������ܵ�Ӱ�죬�ش��������⣺
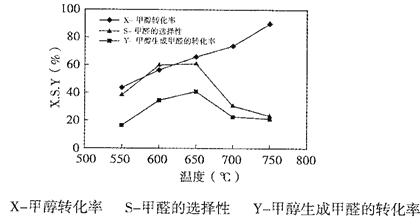
�ٴ�ƽ��ǶȽ���550��-650���״����ɼ�ȩ��ת�������¶����ߵ�ԭ��___________��
�ڷ�Ӧ����i�Ļ��___________(����>����<������=��)CH3OH(g)![]() HCHO(g)+H2(g)��ܡ�
HCHO(g)+H2(g)��ܡ�
��650��~750������Ӧ����ii������___________(����>������<������=��)��Ӧ�����������ʡ�
��4�������Ǵ�����ȩ��ˮ��һ�ֹ��գ��������ʿ��÷���v=0.0423c(mg��L��1��h��1)��ʾ(����cΪ��ȩŨ��)���±�Ϊ�����¼�ȩ��Ũ���洵��ʱ��仯���ݡ�
Ũ��(mg/L) | 10000 | 8000 | 4000 | 2000 | 1000 |
����ʱ��(h) | 0 | 7 | 23 | 39 | 55 |
��ȩŨ��Ϊ2000mg/Lʱ���䴵������v=___________ mg��L��1��h��1�������ϱ����ݣ���ʼŨ��Ϊ10000mg/L������ȩŨ�Ƚ�Ϊ5000mg/L������ʱ��Ϊ___________h��