题目内容
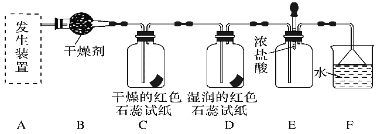
【题目】实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。其装置如下图所示,试回答下列问题。

(1)图中①、②、③、④装置可盛放的试剂是
①________;②________;③________;④________。(将下列有关试剂的序号填入空格内)
A.品红溶液 B.NaOH溶液
C.浓H2SO4 D.酸性KMnO4溶液
(2)能说明二氧化硫气体存在的现象是_____________。
(3)使用装置②的目的是___________。使用装置③的目的是____________。
(4)能说明含有乙烯的现象是____________________________。
【答案】A B A D ①中品红溶液褪色 除去SO2气体 检验SO2气体是否除尽 ③中品红溶液不褪色,④中酸性KMnO4溶液褪色或颜色变浅
【解析】
因为C2H4和SO2都能使溴水和酸性KMnO4溶液褪色,因此,不能确定混合气体中是否含有或者只含有CH2=CH2。由于CH2=CH2不与NaOH溶液反应,也不与品红溶液反应,而SO2却能与NaOH溶液和品红溶液反应,且SO2与品红溶液反应有明显的褪色现象,故可利用此性质差异先检出和除净SO2;再用装置③确认SO2除净之后,才能用酸性KMnO4溶液验证CH2=CH2的存在。
二氧化硫为酸性气体,可与碱反应,可使品红褪色,具有还原性,可与酸性高锰酸钾发生氧化还原反应,而乙烯含有碳碳双键,能够与酸性高锰酸钾发生氧化还原反应使高锰酸钾褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯。则
(1)装置①中盛有品红溶液,用来检验二氧化硫的存在,然后将气体通入盛有氢氧化钠溶液的②除去二氧化硫,再通入盛有品红溶液的③确定二氧化硫是否除干净,最后通入盛有酸性高锰酸钾的④检验乙烯的存在,所以答案为A、B、A、D;
(2)二氧化硫具有漂白性,能够使品红溶液褪色,故能说明二氧化硫气体存在的现象是①中品红溶液褪色;
(3)装置②用来除去SO2气体,以兔干扰乙烯的性质实验;装置③检验SO2是否被除尽,防止干扰乙烯的性质实验;
(4)装置③中的品红溶液不褪色可以排除二氧化硫的干扰,若装置④中酸性KMnO4溶液褪色可证明乙烯的存在。

 名校课堂系列答案
名校课堂系列答案【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)该反应的离子方程式为_______。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
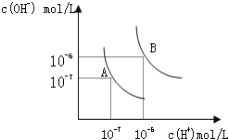
(3)已知50 ℃时c(MnO4—)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO4—)~t的变化曲线示意图_____。

(4)在25 ℃、101 kPa时,1 g CH4完全燃烧生成液态水时放出的热量是55.0kJ,则表示甲烷燃烧热的热化学方程式是____________________________。
(5)已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示。该反应是一个______________(填“熵增”或“熵减”)的反应。下列有关该反应的叙述中正确的是______。
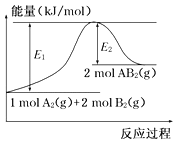
A.该反应是放热反应
B.该反应的ΔH=-(E1-E2) kJ· mol-1
C.该反应中反应物的键能总和大于生成物的键能总和
D.由2 mol A(g)和4 mol B(g)形成4 mol A—B键吸收E2 kJ能量