题目内容
【题目】下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是
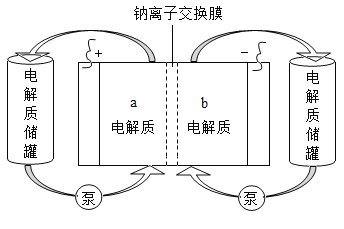
A. 放电时,负极反应为3NaBr - 2e-=== NaBr3 + 2Na+
B. 充电时,阳极反应为2Na2S2 - 2e -=== Na2S4 + 2Na+
C. 放电时,Na+经过离子交换膜,由a池移向b池
D. 用该电池电解饱和食盐水,产生0.1molH2时,b池生成17.40 gNa2S4
【答案】D
【解析】
放电时Na+由b乙池向a池移动,在原电池中, a池为正极,阳离子移向正极,得到电子,发生还原反应,b池为负极,阴离子失去电子,发生氧化反应;充电时与放电相反,a池发生氧化反应,为电解池的阳极,b池发生还原反应,为电解池的阴极,据此分析。
A.放电时,负极反应为2Na2S2-2e-=Na2S4+2Na+,A错误;
B.充电时,阳极反应为3NaBr-2e-=NaBr3+2Na+,B错误;
C.在原电池中,阳离子移向正极,Na+经过离子交换膜,由b池移向a,C错误;
D.该原电池与电解池是串联电路,H+得到电子生成H2与Na2S2失去电子生成Na2S4的电子总数相等,即2H+~H2~2e-~2Na2S2~Na2S4,所以n(Na2S4)=n(H2)=0.1mol,m(Na2S4)=0.1mol×174g/mol=17.40g,D正确;
故合理选项是D。

【题目】回答下列问题:
(1)用“>”或“<”填写下表。
非金属性 | 熔点 | 沸点(同压) | 键能 |
P___S | MgO ___CaS | CF4 ___SiCl4 | H-Cl___H-Br |
(2)一种制取NH2OH的反应为2NO2-+4SO2+6H2O+6NH3=4S042-+6NH4++2NH2OH。
①N、H、O的电负性从小到大的顺序为____。
②NH2OH中N原子的杂化类型为____。
③NHOH极易溶于H2O,除因为它们都是极性分子外,还因为____。
(3)配合物K[PtCl3(NH3)]中[PtCl3(NH3)]-的结构可用示意图表示为_____(不考虑空间构型),1molK[PtCl3(NH3)]中含有σ键的数目为____。