题目内容
【题目】锌锰干电池的负极是作为电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生MnOOH。废旧电池中的Zn、Mn元素的回收,对环境保护有重要的意义。
Ⅰ.回收锌元素,制备ZnCl2
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得固体和滤液。
步骤二:处理滤液,得到ZnCl2·xH2O晶体。
步骤三:将SOCl2与ZnCl2·xH2O晶体混合制取无水ZnCl2。
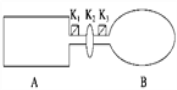
制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)的装置如图:

(已知:SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃,140℃以上时易分解,与水剧烈反应生成两种气体。)
(1)写出SOCl2与水反应的化学方程式:__。
(2)接口的连接顺序为a→__→__→h→i→__→__→__→e。
Ⅱ.回收锰元素,制备MnO2
(3)洗涤步骤一得到的固体,判断固体洗涤干净的方法:__。
(4)洗涤后的固体经初步蒸干后进行灼烧,灼烧的目的:__。
Ⅲ.二氧化锰纯度的测定
称取1.40g灼烧后的产品,加入2.68g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参与反应),充分反应后冷却,将所得溶液转移到100mL容量瓶中用蒸馏水稀释至刻线,从中取出20.00mL,用0.0200mol/L高锰酸钾溶液进行滴定,滴定三次,消耗高锰酸钾溶液体积的平均值为17.30mL。
(5)写出MnO2溶解反应的离子方程式__。
(6)产品的纯度为__。
(7)若灼烧不充分,滴定时消耗高锰酸钾溶液体积__(填“偏大”“偏小”“不变”)。
【答案】SOCl2+H2O=SO2↑+2HCl↑ f g b c d 取最后一次洗液,滴加稀HNO3酸化的AgNO3溶液,若无白色沉淀生成,则说明固体洗涤干净 除去碳粉,并将MnOOH氧化为MnO2 MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O 97.4% 偏大
【解析】
根据实验原理及实验装置图,分析装置的链接顺序;根据题干信息中物质的性质及氧化还原反应原理书写相关反应方程式;根据滴定原理计算产品纯度并进行误差分析。
(1)根据已知条件,SOCl2与水反应生成与水剧烈反应生成两种气体,根据元素守恒判断为SO2和HCl,则反应方程式为SOCl2+H2O=SO2↑+2HCl↑,故答案为:SOCl2+H2O=SO2↑+2HCl↑;
(2)三颈烧瓶中SOCl2吸收结晶水得到SO2与HCl,用冰水冷却收集SOCl2,浓硫酸吸收水蒸气,防止后面溶液中的水蒸气进入锥形瓶中,用品红溶液检验SO2,用氢氧化钠溶液吸收尾气中的SO2与HCl,防止污染环境,h装置防止倒吸,接口的连接顺序为a→f→g→h→i→b→c→d→e,故答案为:f;g;b ; c;d;
(3)判断固体洗涤干净的方法是检验洗涤液中有没有Cl-:取最后一次洗液,滴加稀HNO3酸化的AgNO3溶液,若无白色沉淀生成,则说明固体洗涤干净,故答案为:取最后一次洗液,滴加稀HNO3酸化的AgNO3溶液,若无白色沉淀生成,则说明固体洗涤干净;
(4)灼烧除去碳,并将MnOOH氧化为MnO2,故答案为:除去碳粉,并将MnOOH氧化为MnO2;
(5)在H+作用下,KMnO4、MnO2与C2O![]() 反应的离子方程式分别为2MnO
反应的离子方程式分别为2MnO![]() +5C2O
+5C2O![]() +16H+=2Mn2++10CO2↑+8H2O、MnO2+C2O
+16H+=2Mn2++10CO2↑+8H2O、MnO2+C2O![]() +4H+===Mn2++2CO2↑+2H2O,故答案为:MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O;
+4H+===Mn2++2CO2↑+2H2O,故答案为:MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O;
(6)n(C2O![]() )=2.68g÷134g·mol-1=0.02mol;滴定100mL稀释后溶液,消耗n(MnO
)=2.68g÷134g·mol-1=0.02mol;滴定100mL稀释后溶液,消耗n(MnO![]() )=0.0200mol·L-1×0.01730L×5=0.001730mol;根据氧化还原反应中得失电子数相等得n(MnO2)×2+0.001730mol×5=0.0200mol×2,得n(MnO2)=0.015675mol,MnO2的质量分数=
)=0.0200mol·L-1×0.01730L×5=0.001730mol;根据氧化还原反应中得失电子数相等得n(MnO2)×2+0.001730mol×5=0.0200mol×2,得n(MnO2)=0.015675mol,MnO2的质量分数=![]() =0.974,即97.4%,故答案为:97.4%;
=0.974,即97.4%,故答案为:97.4%;
(7)若灼烧不充分,杂质也会消耗高锰酸钾,滴定时消耗高锰酸钾溶液体积将偏大,故答案为:偏大。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】某化学实验小组用酸性KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
I | 向一支试管中先加入1mL 0.01 mol/L酸性 KMnO4溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入1mL 0.1mol/L草酸溶液 | 前10min内溶液紫色无明显变化,后颜色逐渐变浅, 30 in后几乎变为无色 |
II | 向另一支试管中先加入1mL 0.01mol/L酸性 KMnO4溶液,再加入10滴3mol/L硫酸,最后加入1mL 0.1mol/L草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
(1)高锰酸钾与草酸反应的离子方程式:______________________________________
(2)由实验I、II可得出的结论是____________________________。
(3)关于实验II中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01mol/L酸性 KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
① 补全实验III的操作:向试管中先加入1mL 0.01mol/L酸性 KMnO4溶液,______,最后加入1mL 0.1mol/L草酸溶液。
② 若猜想成立,应观察到的实验现象是______。
(4)该小组拟采用如图所示的实验方案继续探究外界条件对反应速率的影响。
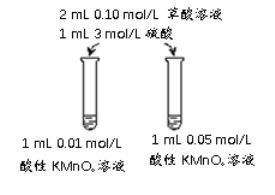
① 他们拟研究的影响因素是______。
② 你认为他们的实验方案______(填“合理”或“不合理”),理由是______。
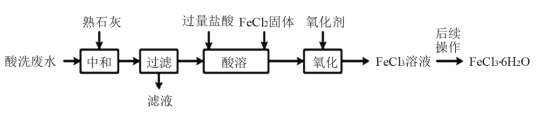
【题目】金属蚀刻加工过程中,常用盐酸对其表面氧化物进行清洗,会产生酸洗废水。 pH在1.5左右的某酸洗废水中含铁元素质量分数约3%,其他金属元素如铜、镍、锌、 铬浓度较低,工业上综合利用酸洗废水可制备三氯化铁。制备过程如下:
相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Ni(OH)2 | Zn(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 7.1 | 5.4 | 4.3 | 7.6 |
沉淀完全的pH | 3.7 | 6.7 | 9.2 | 8.0 | 5.6 | 9.6 |
回答下列问题:
(1)“中和”时发生反应的化学方程式为__________________,调节pH至________范围,有利于后续制备得纯度较高的产品。
(2)酸溶处理中和后的滤渣,使铁元素浸出。滤渣和工业盐酸反应时,不同反应温度下 铁浸出率随时间变化如图(a)所示,可知酸溶的最佳温度为_______________。按照不同的固液比(滤渣和工业盐酸的投入体积比)进行反应时,铁浸出率随时间变化如图(b)所示,实际生产中固液比选择1.5:1的原因是___________。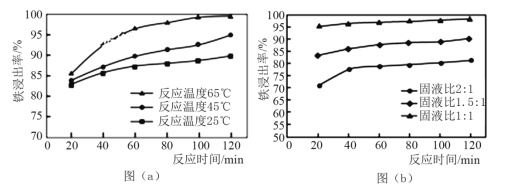
(3)氧化时,可选氯酸钠或过氧化氢为氧化剂,若100L“酸溶”所得溶液中Fe 2+含量为1.2molL1,则需投入的氧化剂过氧化氢的质量为__________。
(4)氧化时,除可外加氧化剂外,也可采用惰性电极电解的方法,此时阴极的电极反应式为__________,电解总反应的离子方程式是 __________。
(5)将得到的FeCl3溶液在HCl气氛中______、______、过滤、洗涤、干燥得FeCl36H2O晶体。