题目内容
【题目】某化学实验小组用酸性KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
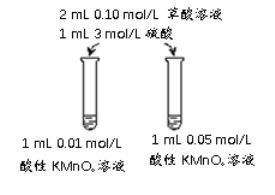
I | 向一支试管中先加入1mL 0.01 mol/L酸性 KMnO4溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入1mL 0.1mol/L草酸溶液 | 前10min内溶液紫色无明显变化,后颜色逐渐变浅, 30 in后几乎变为无色 |
II | 向另一支试管中先加入1mL 0.01mol/L酸性 KMnO4溶液,再加入10滴3mol/L硫酸,最后加入1mL 0.1mol/L草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
(1)高锰酸钾与草酸反应的离子方程式:______________________________________
(2)由实验I、II可得出的结论是____________________________。
(3)关于实验II中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01mol/L酸性 KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
① 补全实验III的操作:向试管中先加入1mL 0.01mol/L酸性 KMnO4溶液,______,最后加入1mL 0.1mol/L草酸溶液。
② 若猜想成立,应观察到的实验现象是______。
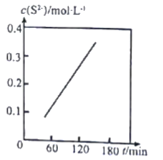
(4)该小组拟采用如图所示的实验方案继续探究外界条件对反应速率的影响。
① 他们拟研究的影响因素是______。
② 你认为他们的实验方案______(填“合理”或“不合理”),理由是______。
【答案】2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O 其他条件相同时,H+(或硫酸)浓度越大,反应速率越快 再加入10滴3 mol/L硫酸,然后加入少量MnSO4固体 加入草酸溶液后,溶液紫色迅速变浅(或溶液颜色开始变浅的时间小于80 s,或其他合理答案) KMnO4溶液浓度 不合理 KMnO4溶液浓度不同,溶液起始颜色深浅不同,无法通过比较褪色时间长短判断反应快慢
【解析】
(1)高锰酸钾具有强氧化性,草酸有还原性,可发生氧化还原反应,生成硫酸锰、二氧化碳和水;
(2)对比实验I、II,加入酸的量不同,总体积相同,则氢离子浓度不同;
(3)①加入试剂的总体积仍旧为10滴溶液,且初始量(条件)与实验II相同,且需要加入一定量的硫酸锰;
②若Mn2+对反应有催化作用,加入草酸溶液后,则溶液迅速褪色;
(4)①根据图像信息,使用的高锰酸钾的浓度不同;
②高锰酸钾的浓度不同,导致溶液颜色深浅不同,设计不合理。
(1)高锰酸钾具有强氧化性,草酸有还原性,可发生氧化还原反应,生成硫酸锰、二氧化碳和水,离子方程式为2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O;
(2)对比实验I、II,加入酸的量不同,总体积相同,则氢离子浓度越大,反应速率越快;
(3)①加入试剂的总体积仍旧为10滴溶液,且初始量(条件)与实验II相同,且需要加入一定量的硫酸锰溶液,则再加入10滴3 mol/L硫酸,然后加入少量MnSO4固体;
②若Mn2+对反应有催化作用,加入草酸后,则溶液迅速褪色;
(4)①根据图像信息,使用的高锰酸钾的浓度不同,则探究因素为高锰酸钾的浓度对反应速率的影响;
②高锰酸钾溶液有颜色,高锰酸钾的浓度不同,导致溶液颜色深浅不同,无法通过比较褪色时间长短判断反应快慢,设计不合理。