题目内容
【题目】金属蚀刻加工过程中,常用盐酸对其表面氧化物进行清洗,会产生酸洗废水。 pH在1.5左右的某酸洗废水中含铁元素质量分数约3%,其他金属元素如铜、镍、锌、 铬浓度较低,工业上综合利用酸洗废水可制备三氯化铁。制备过程如下:
相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Ni(OH)2 | Zn(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 7.1 | 5.4 | 4.3 | 7.6 |
沉淀完全的pH | 3.7 | 6.7 | 9.2 | 8.0 | 5.6 | 9.6 |
回答下列问题:
(1)“中和”时发生反应的化学方程式为__________________,调节pH至________范围,有利于后续制备得纯度较高的产品。
(2)酸溶处理中和后的滤渣,使铁元素浸出。滤渣和工业盐酸反应时,不同反应温度下 铁浸出率随时间变化如图(a)所示,可知酸溶的最佳温度为_______________。按照不同的固液比(滤渣和工业盐酸的投入体积比)进行反应时,铁浸出率随时间变化如图(b)所示,实际生产中固液比选择1.5:1的原因是___________。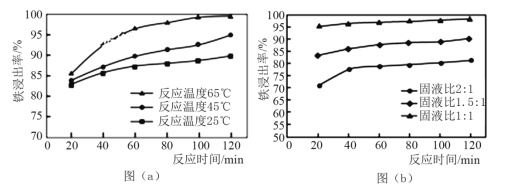
(3)氧化时,可选氯酸钠或过氧化氢为氧化剂,若100L“酸溶”所得溶液中Fe 2+含量为1.2molL1,则需投入的氧化剂过氧化氢的质量为__________。
(4)氧化时,除可外加氧化剂外,也可采用惰性电极电解的方法,此时阴极的电极反应式为__________,电解总反应的离子方程式是 __________。
(5)将得到的FeCl3溶液在HCl气氛中______、______、过滤、洗涤、干燥得FeCl36H2O晶体。
【答案】Ca(OH)2+2HCl = CaCl2 + 2H2O、3Ca(OH) 2+2FeCl3 = 2Fe(OH)3↓+3CaCl2 3.74.2 65℃ 固液比大则铁浸出率低,固液比小则过稀的FeCl3溶液蒸发浓缩需消耗过多的能量,提高了成本 2040g 2H++2e- = H2↑; 2Fe2++2H+ ![]() 2Fe3++H2↑ 蒸发浓缩 冷却结晶
2Fe3++H2↑ 蒸发浓缩 冷却结晶
【解析】
酸洗废水中含有氯化铁、氯化铜、氯化镍、氯化铬等,根据图示流程可知,利用酸洗废水可制备三氯化铁的方法为:先向酸洗废水中加入熟石灰后发生反应:Ca(OH)2+2HCl=CaCl2+2H2O、3Ca(OH)2+2FeCl3=2Fe(OH)3+3CaCl2,调节溶液pH使铁离子转化成氢氧化铁沉淀,过滤后得到含有氢氧化铁的滤渣;再经过酸溶处理中和后的滤渣,使铁元素浸出,然后加入已经氧化得到氯化铁溶液,最后在HCl气流中采用蒸发浓缩、冷却结晶的方法,然后通过过滤、洗涤、干燥得到FeCl36H2O晶体。
(1)酸洗废水中含有氯化铁、氯化铜、氯化镍、氯化铬,加入熟石灰后发生反应:Ca(OH)2 + 2HCl=CaCl2+2H2O、3Ca(OH) 2+2FeCl3=2Fe(OH)3↓+3CaCl2;根据表中数据可知,pH≥3.7时铁离子完全转化成氢氧化铁沉淀,pH<4.2时铜离子等其它离子没有形成沉淀,为了减少滤渣中杂质,需要调节溶液pH范围为3.74.2;故答案为:Ca(OH)2+2HCl = CaCl2 + 2H2O、3Ca(OH) 2+2FeCl3 = 2Fe(OH)3↓+3CaCl2;3.74.2。
(2)根据图(a)可知,温度为65℃时铁浸出率最高,所以酸溶的最佳温度为65℃;根据图(b)可知,固液比越大铁浸出率越低,但固液比过低时,蒸发浓缩FeCl3溶液需消耗过多的能量,提高了生生产成本,所以实际生产中固液比选择1.5:1;故答案为:65℃;固液比大则铁浸出率低,固液比小则过稀的FeCl3溶液蒸发浓缩需消耗过多的能量,提高了成本。
(3)若100L“酸溶”所得溶液中Fe2+含量为1.2 molL1,则n(Fe2+)=1.2molL1×100L=120mol,根据电子守恒,需投入的氧化剂过氧化氢的物质的量为:![]() ,质量为:34gmol1×60mol=2040g;故答案为:2040g。
,质量为:34gmol1×60mol=2040g;故答案为:2040g。
(4)氧化时,除可外加氧化剂外,也可采用惰性电极电解的方法,此时阴极氢离子得到电子生成氢气,阴极电极反应式为:2H++2e- = H2↑,阳极亚铁离子失去电子生成铁离子,电解总反应为亚铁离子与氢离子反应生成铁离子和氢气,该离子方程式是:2Fe2++2H+ ![]() 2Fe3++H2↑;故答案为:2H++2e- = H2↑;2Fe2++2H+
2Fe3++H2↑;故答案为:2H++2e- = H2↑;2Fe2++2H+ ![]() 2Fe3++H2↑。
2Fe3++H2↑。
(5)氯化铁加热易水解生成氢氧化铁和氯化氢,HCl易挥发,要从FeCl3溶液中得到FeCl36H2O晶体,需要在HCl气流中采用蒸发浓缩、冷却结晶的方法,然后通过过滤、洗涤、干燥得到FeCl36H2O晶体;故答案为:蒸发浓缩、冷却结晶。