题目内容
8.甲、乙、丙、丁、戊为五种短周期元素.甲、乙、丙是原子序数依次递增且相邻的同周期元素,且最外层电子数之和为15,甲与丙可形成含有极性键的直线分子;乙与丁形成的气态化合物在标准状况下的密度为0.76g/L,其水溶液呈碱性;戊与丙反应,能生成两种离子化合物,其中一种为淡黄色.请回答下列问题(用推出的元素符号表示,下同):
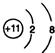
(1)戊离子的结构示意图为
 ;
;(2)由甲、乙、丙三种元素分别与氢能形成多种化合物,写出其中为三角锥形分子的电子式
 ;仅由极性键形成的非极性分子的结构式为
;仅由极性键形成的非极性分子的结构式为 ,该分子中心原子的杂化轨道类型是sp3杂化;简单氢化物的沸点最高的是H2O.
,该分子中心原子的杂化轨道类型是sp3杂化;简单氢化物的沸点最高的是H2O.(3)乙、丙、戊简单离子的半径由大到小的顺序是N3->O2->Na+(用离子符号表示).
(4)一种常见的化肥是由甲、乙、丙、丁四种元素组成的离子化合物,其化学键类型有离子键和共价键,该化合物的水溶液与足量的氢氧化钠溶液共热反应的离子方程式为NH+4+HCO3-+2OHˉ$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+CO32-.
(5)常温下乙的一种气态氢化物与单质丙发生置换反应,反应中消耗1mol单质丙时生成1mol单质乙,同时放出热量534kJ.写出该反应的热化学方程式:N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-534kJ•mol-1.
分析 由题给的条件可知,甲、乙、丙、丁、戊这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有甲、乙、丙三种元素是原子序数依次递增的同周期元素,且最外层电子数之和为15,乙与丁形成的气态化合物在标准状况下的密度为0.76g/L,可计算出该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,其水溶液呈碱性,则该气体为氨气,则乙为氮元素,丁为氢元素,进而推断甲为碳元素,丙为氧元素,甲与丙可形成含有极性键的直线分子,应为二氧化碳,戊与丙反应,能生成两种离子化合物,其中一种为淡黄色,应为过氧化钠,所以戊为钠元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答 解:由题给的条件可知,甲、乙、丙、丁、戊这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有甲、乙、丙三种元素是原子序数依次递增的同周期元素,且最外层电子数之和为15,乙与丁形成的气态化合物在标准状况下的密度为0.76g/L,可计算出该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,其水溶液呈碱性,则该气体为氨气,则乙为氮元素,丁为氢元素,进而推断甲为碳元素,丙为氧元素,甲与丙可形成含有极性键的直线分子,应为二氧化碳,戊与丙反应,能生成两种离子化合物,其中一种为淡黄色,应为过氧化钠,所以戊为钠元素,
(1)戊为钠元素,戊离子的结构示意图为 ,故答案为:
,故答案为: ;
;
(2)由C、N、O三种元素分别与氢能形成多种化合物,其中为三角锥形分子的应为氨气,它的电子式为 ,仅由极性键形成的非极性分子应为甲烷,它的结构式为
,仅由极性键形成的非极性分子应为甲烷,它的结构式为  ,该分子中心原子的价层电子对数为$\frac{4+4}{2}$=4,所以碳原子的杂化轨道类型是sp3杂化,C、N、O三种元素的简单氢化物的沸点最高的是H2O,
,该分子中心原子的价层电子对数为$\frac{4+4}{2}$=4,所以碳原子的杂化轨道类型是sp3杂化,C、N、O三种元素的简单氢化物的沸点最高的是H2O,
故答案为: ;
; ;sp3杂化;H2O;
;sp3杂化;H2O;
(3)离子的电子层数相同时,核电荷数越多,离子半径越小,N3-、O2-、Na+的半径由大到小的顺序是N3->O2->Na+,
故答案为:N3->O2->Na+;
(4)是由C、O、N、H四种元素组成的一种常见的化肥且为离子化合物,则该物质为NH4HCO3,其化学键类型有离子键和共价键,NH4HCO3的水溶液与足量的氢氧化钠溶液共热反应的离子方程式为NH+4+HCO3-+2OHˉ$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+CO32-,
故答案为:离子键和共价键;NH+4+HCO3-+2OHˉ$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+CO32-;
(5)乙为氮元素,常温下乙的一种气态氢化物与氧气发生置换反应,反应中消耗1mol氧气时生成1mol氮气,根据元素守恒和电子得失守恒可知,反应方程式为N2H4+O2═N2+2H2O,同时放出热量534kJ,则该反应的热化学方程式为N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-534kJ•mol-1,
故答案为:N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-534kJ•mol-1.
点评 本题主要考查了电子式、结构式、原子杂化轨道、离子半径比较、离子方程式书写、热化学方程式的书写等知识,元素推断是解题的关键,需要注意根据原子结构和物质的物理性质确定元素种类,题目难度中等.

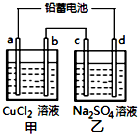 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{放电}^{充电}$2PbSO4(s)+2H2O(l)
电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-═PbSO4(s)+2H2O(l) | |
| C. | 若利用甲池精炼铜,b极应为粗铜 | |
| D. | 若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L(标准状况下) |
| A. | H2、I2、HI平衡混合气体加压后颜色变深 | |
| B. | 夏天,打开冰镇啤酒瓶,立即冒出大量泡沫 | |
| C. | 生活中,用饱和碳酸钠溶液洗去锅碗瓢盆上的油污,且热溶液的效果更好 | |
| D. | 侯氏制碱工业中,降温析出副产品NH4Cl之前,向溶液中既撒NaCl固体又通入足量NH3 |
 下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:
下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(2)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上十二种元素分别属于s区、d区和ds区,则属于s区的元素有2种,属于d区的元素有8种.
(3)试比较:第一电离能I1(Ga)<I1(Ge)(填“>”、“<”或“=”).
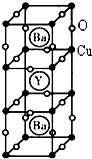
(4)钇钡铜氧是一种新型节能高温超导体,其晶胞结构如图所示,研究发现,此高温超导体中的Cu元素有两种价态,分别为+2价和+3价,Y元素的化合价为+3价,Ba元素的化合价为+2价.
①该物质的化学式为:YCu3Ba2O7.
②该物质中Cu2+与Cu3+的原子个数比为:2:1.
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与任何碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富 | |
| D. | 工业上可以用电解法冶炼铝 |
| A. | 一定含甲烷 | B. | 一定有乙烷 | ||
| C. | 一定是甲烷和乙烯的混合气体 | D. | 一定是甲烷和丙炔的混合气体 |
| A. | 酒精及其他易燃物小面积失火,应该迅速使用湿抹布扑盖;钠、钾等失火应用泡沫灭火器扑灭 | |
| B. | 用排水法收集气体时,先撤酒精灯后移出导管 | |
| C. | 少量氢氧化钠溶液沾在皮肤上,立即用水冲洗,再涂碳酸氢钠溶液 | |
| D. | 有大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向高处跑 |