题目内容
8.甲烷作为一种新能源在化学领域应用广泛,用作燃料电池的电极反应为:负极:CH4+10OH--8e-═CO32-+7H2O,正极:2O2+4H2O+8e-═8OH-,该电池工作时,下列叙述正确的是( )| A. | 氧气发生氧化反应 | |
| B. | 每转移2mol电子,电池内增加2molH2O | |
| C. | C正极附近c(H+)增大 | |
| D. | 负极附近溶液的pH值降低 |
分析 碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,根据电极反应确定液的pH变化情况以及电子转移和物质量之间的关系.
解答 解:A.氧气得电子,被还原生成OH-,故A错误;
B.由电极方程式可知总反应为CH4+2O2+2OH-=CO32-+3H2O,则每转移2mol电子,电池内增加$\frac{3}{4}$molH2O,故B错误;
C.正极电极反应式为O2+2H2O+4e-=4OH-,c(OH-)增大,则c(H+)减小,故C错误;
D.负极发生CH4+10OH--8e-=CO32-+7H2O,c(OH-)减小,则pH减小,故D正确.
故选D.
点评 本题考查了甲烷燃料电池,根据电极上得失电子、电子流向、原电池的概念来分析解答即可,注意燃料电池中,通入燃料的电极为负极,通入氧化剂的电极为正极,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.如图是某煤发电厂处理废气的原理示意图,下列说法正确的是( )
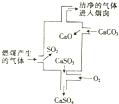

| A. | 使用此废气处理工艺不能减少SO2的排放 | |
| B. | 该过程发生的反应有化合、分解、置换和氧化还原反应 | |
| C. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 | |
| D. | 可用NaOH溶液检验废气处理是否达标 |
19.现代化学键理论认为苯环结构中不存在单双键交替结构,可以作为证据的事实是( )
①苯不能使KMnO4溶液褪色
②苯中碳碳键的键能均相等
③苯能在一定条件下跟H2加成生成环己烷
④经实验测得邻二甲苯仅一种结构
⑤苯在FeBr3存在的条件下同液溴可发生取代反应,但不因化学变化而使溴水褪色.
①苯不能使KMnO4溶液褪色
②苯中碳碳键的键能均相等
③苯能在一定条件下跟H2加成生成环己烷
④经实验测得邻二甲苯仅一种结构
⑤苯在FeBr3存在的条件下同液溴可发生取代反应,但不因化学变化而使溴水褪色.
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②③④ | D. | ①②④⑤ |
16.已知甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下:下列说法不正确的( )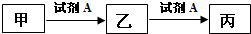
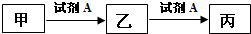
| A. | 若A为硝酸,X为金属元素,则甲与丙反应可生成乙 | |
| B. | 若乙为NaHCO3,则丙一定是CO2 | |
| C. | 若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质 | |
| D. | 若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀 |
3.从海水中可以提取溴,但得到的液溴中常常溶有少量氯气,除去氯气应该采用的方法有( )
| A. | 加入适量的FeCl2溶液 | B. | 加入适量的KBr溶液 | ||
| C. | 加入适量的饱和食盐水 | D. | 加入适量的Na2S溶液 |
20.下列与物质分类相关的说法正确的是( )
| A. | 只含一种分子的物质一定是纯净物 | |
| B. | 由Na2O2制取O2一定要加入氧化剂 | |
| C. | 金属氧化物一定是碱性氧化物 | |
| D. | 含氧酸受热分解都能生成对应的酸酐和水 |
17.已知重铬酸钾(K2Cr2O7)是一种比高锰酸钾还要强的氧化剂,其溶液中存在如下平衡:2CrO42-(黄色)+2H +?Cr2O72-(橙色)+H2O若要使溶液的橙色加深,下列可采用的方法是( )
| A. | 加入适量稀盐酸 | B. | 加入适量稀硫酸 | ||
| C. | 加入适量烧碱固体 | D. | 加水稀释 |