题目内容
3.下列反应(均已配平)中,氧化剂与还原剂物质的量的关系不是1:1的是( )| A. | 3Cl2+6NaOH$\frac{\underline{\;△\;}}{\;}$5NaCl+NaClO3+3H2O | |
| B. | Fe+CuSO4=FeSO4+Cu | |
| C. | Cu+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O | |
| D. | 2Na+2HCl═2NaCl+H2↑ |
分析 根据化合价降低作氧化剂,化合价升高作还原剂分析判断.
解答 解:A.3molCl2参加反应,$\frac{1}{2}$molCl2作还原剂,$\frac{5}{2}$molCl2作氧化剂,则氧化剂与还原剂物质的量之比为5:1,故A选;
B.Fe+CuSO4=FeSO4+Cu反应,1molCuSO4化合价降低作氧化剂,1molFe化合价升高作还原剂,则氧化剂与还原剂物质的量之比为1:1,故B不选;
C.在Cu+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O反应中1molH2SO4(浓)化合价降低作氧化剂,1molCu化合价升高作还原剂,则氧化剂与还原剂物质的量之比为l:1,故C不选;
D.在2Na+2HCl═2NaCl+H2↑反应中2molHCl化合价降低作氧化剂,2molNa化合价升高作还原剂,则氧化剂与还原剂物质的量之比为l:1,故D不选;
故选A.
点评 本题考查氧化还原反应,明确元素化合价是解本题关键,注意只有化合价降低的才作氧化剂,化合价升高才作还原剂,为易错点.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
14.下列关于化学反应与能量的说法正确的是( )
| A. | 中和反应是放热反应 | |
| B. |  H2燃烧时的能量变化如图所示 | |
| C. | 化学键断裂放出能量 | |
| D. | 反应物总能量与生成物总能量一定相等 |
2.下列物质的电子式正确的是( )
| A. |  | B. | H+[O]2-H+ | C. | Na+[Cl]- | D. | Mg2+[F]$_2^-$ |
3.向NaOH和Na2CO3混合溶液中滴加0.1mol/L盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示,下列判断正确的是( )


| A. | 在0~a范围内,只发生中和反应 | |
| B. | ab段发生反应的离子方程式为CO32-+2H+═H2O+CO2 | |
| C. | 原混合溶液中NaOH和Na2CO3的物质的量浓度之比为2:1 | |
| D. | c点对应的溶液中还能大量存在Fe2+、NO3-离子 |
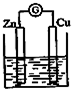 X,Y,Z,W为按原子序数由小到大排列的四种短周期的元素,X的阳离子为质子,Y原子有3个能级,各能级电子数相等,Z,W位于同一周期,Z是该周期中金属性最强的元素,W的单质是黑火药的重要成分,含有该单质的某种膏药可治疗某些皮肤病.请回答下列问题:
X,Y,Z,W为按原子序数由小到大排列的四种短周期的元素,X的阳离子为质子,Y原子有3个能级,各能级电子数相等,Z,W位于同一周期,Z是该周期中金属性最强的元素,W的单质是黑火药的重要成分,含有该单质的某种膏药可治疗某些皮肤病.请回答下列问题: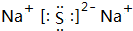 .
.