题目内容
3.镁-次氯酸盐燃料电池,它具有比能量高、安全方便等优点.该电池的正极反应式为:ClO-+H2O+2e-=Cl-+2OH-,关于该电池的叙述正确的是( )| A. | 该电池中镁为负极,发生还原反应 | |
| B. | 电池工作时,OH-向正极移动 | |
| C. | 该电池的总反应为:Mg+ClO-+H2O=Mg(OH)2↓+Cl- | |
| D. | 电池工作时,正极周围溶液的pH将不断变小 |
分析 该原电池中,镁作负极,负极上镁失电子发生氧化反应,正极上次氯酸根离子得电子发生还原反应,电池反应式为:Mg+ClO-+H2O=Mg(OH)2↓+Cl-,原电池放电时,电解质溶液中阳离子向正极移动,阴离子向负极移动.
解答 解:A.负极发生氧化反应,故A错误;
B.原电池原理中,阴离子向负极移动,阳离子向正极移动,故B错误;
C.负极上镁失电子,正极上次氯酸根离子得电子,所以电池反应为Mg+ClO-+H2O=Mg(OH)2↓+Cl-,故C正确;
D.电池工作时正极上的反应为:ClO-+H2O+2e-=Cl-+2OH-,在正极附近生成OH-,故pH增大,故D错误;
故选C.
点评 本题考查原电池(燃料电池)基本原理,涉及电极判断、电极反应书写、离子流动等相关知识,难度不大.

练习册系列答案
相关题目
13.如表为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是( )
| Q | R | ||
| T | W | ||
| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子结构示意图为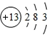 | |
| C. | 与W同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 | |
| D. | W可形成多种含氧酸 |
11.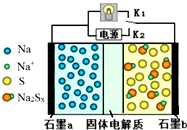 高温钠硫电池是一种新型可充电电池,其工作原理如图所示,图中固体电解质是Na+导体.下列叙述正确的是( )
高温钠硫电池是一种新型可充电电池,其工作原理如图所示,图中固体电解质是Na+导体.下列叙述正确的是( )
 高温钠硫电池是一种新型可充电电池,其工作原理如图所示,图中固体电解质是Na+导体.下列叙述正确的是( )
高温钠硫电池是一种新型可充电电池,其工作原理如图所示,图中固体电解质是Na+导体.下列叙述正确的是( )| A. | 放电时,石墨电极a为正极 | |
| B. | 放电时,Na+从石墨b向石墨a方向迁移 | |
| C. | 充电时,b极反应为Na2Sx-2e-=xS+2Na+ | |
| D. | 可将装置中的固体电解质改成NaCl溶液 |
18.在FeCl3溶液中,c(Fe3+)与c(Cl-)的关系是( )
| A. | c(Fe3+)=c(Cl-) | B. | 3c(Fe3+)=c(Cl-) | C. | 3c(Fe3+)>c(Cl-) | D. | 3c(Fe3+)<c(Cl-) |
15.不用其他化学试剂(可以加热或利用水)就能区别开的一组物质是( )
| A. | 苯、甲苯、四氯化碳 | B. | 酒精、硝基苯、四氯化碳 | ||
| C. | 溴苯、苯、四氯化碳 | D. | 酒精、甲苯、四氯化碳 |

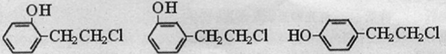 或
或 .
. ,请写出其涉及的反应(著注明反应的条件)
,请写出其涉及的反应(著注明反应的条件) 、
、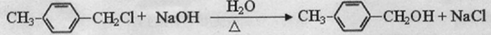 .
.
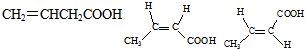 .
.