题目内容
8. 向Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入NaOH体积V之间的关系如图所示.则混合溶液中Al2(SO4)3和MgSO4的物质的量之比为1:2.
向Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入NaOH体积V之间的关系如图所示.则混合溶液中Al2(SO4)3和MgSO4的物质的量之比为1:2.
分析 Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,发生的离子方程式为Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,b点沉淀为Mg(OH)2、Al3++3OH-=Al(OH)3,c点氢氧化铝沉淀恰好溶解,溶液中沉淀只有氢氧化镁,溶质为NaAlO2,
根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,铝离子生成沉淀和沉淀溶解消耗氢氧化钠体积之比为3:1,所以生成Al(OH)3沉淀需要氢氧化钠体积=3×(6-5)mL=3mL,则生成Mg(OH)2沉淀消耗氢氧化钠体积=(5-3)mL=2mL,结合方程式、原子守恒判断混合溶液中Al2(SO4)3和MgSO4的物质的量之比.
解答 解:Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,发生的离子方程式为 Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,b点沉淀为Mg(OH)2、Al3++3OH-=Al(OH)3,c点氢氧化铝沉淀恰好溶解,溶液中沉淀只有氢氧化镁,溶质为NaAlO2,
根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,铝离子生成沉淀和沉淀溶解消耗氢氧化钠体积之比为3:1,所以生成Al(OH)3沉淀需要氢氧化钠体积=3×(6-5)mL=3mL,则生成Mg(OH)2沉淀消耗氢氧化钠体积=(5-3)mL=2mL,
根据方程式Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓知,镁离子和铝离子物质的量之比=$\frac{2mL}{2}$:$\frac{3mL}{3}$=1:1,根据原子守恒得n(Mg2+)=n(MgSO4)、n[Al2(SO4)3]=$\frac{1}{2}$n(Al3+),所以Al2(SO4)3和MgSO4的物质的量之比为$\frac{1}{2}$:1=1:2,
故答案为:1:2.
点评 本题考查离子方程式有关计算,为高频考点,侧重考查学生分析计算能力,明确铝离子生成沉淀和沉淀消失消耗氢氧化钠体积之比是解本题关键,注意结合原子守恒分析解答.

| A. | Na与H2O反应:Na+H2O═Na++OH-+H2↑ | |
| B. | Cu与浓硫酸:Cu+2H+═Cu2++H2↑ | |
| C. | Fe能溶于FeCl3溶液:Fe+Fe3+═2Fe2+ | |
| D. | SiO2与NaOH溶液:SiO2+2OH-═SiO32-+H2O |
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 1:6 |
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 密闭容器中发生反应H2+I2=2HI,增大压强时,容器中颜色加深 | |
| C. | 将混合气中的氨气液化后不停的分离出来,有利于合成氨的反应 | |
| D. | 用过量空气煅烧硫铁矿可以提高硫铁矿的利用率 |
| A. | 少量CO2通入过量氨水中:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 含等物质的量的NH4HSO3与NaOH溶液混合加热:HSO3-+OH-$\frac{\underline{\;△\;}}{\;}$SO32-+H2O | |
| C. | 溴化亚铁溶液中通入少量Cl2:Cl2+2Br-═2Cl-+Br2 | |
| D. | 含1molKOH的溶液与含2molBa(HCO3)2的溶液混合:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O |
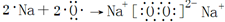 .
. 某研究性学习小组参照课文中的实验装置图做高温下铁与水蒸气反应的实验装置如图.在玻璃管中放入铁粉和石棉绒的混合物,加热,并通入水蒸气.用试管收集产生的干燥气体,并靠近火焰点火,观察现象.请回答下列问题:
某研究性学习小组参照课文中的实验装置图做高温下铁与水蒸气反应的实验装置如图.在玻璃管中放入铁粉和石棉绒的混合物,加热,并通入水蒸气.用试管收集产生的干燥气体,并靠近火焰点火,观察现象.请回答下列问题: