题目内容
3.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题: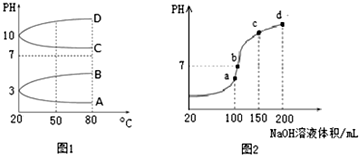
(1)相同条件下,0.1mol•L-1NH4Al(SO4)2中c(NH4+)小于(填“等于”、“大于”或“小于”)0.1mol•L-1NH4HSO4中c(NH4+).
(2)如图1是0.1mol•L-1电解质溶液的pH随温度变化的图象.
①其中符合0.1mol•L-1NH4Al(SO4)2的pH随温度变化的曲线是A(填写字母);
②20℃时,0.1mol•L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=10-3-10-11mol•L-1(填数值表达式).
(3)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.
试分析图中a、b、c、d四个点,水的电离程度最大的是a;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
分析 (1)铝离子、氢离子抑制铵根离子水解,且铝离子抑制程度小于氢离子;
(2)①NH4Al(SO4)2为强酸弱碱盐,其溶液呈酸性,升高温度促进水解;
②根据电荷守恒计算;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性.
解答 解:(1)NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小,
故答案为:小于;
(2)①NH4Al(SO4)2为强酸弱碱盐,其溶液呈酸性,升高温度促进水解,导致溶液酸性增强,溶液的pH减小,则A正确,
故答案为:A;
②20℃时,0.1 mol•L-1NH4Al(SO4)2溶液pH=3,c(H+)=10-3mol•L-1,由电荷守恒可知:2c(SO42-)+c(OH-)=c(NH4+)+3c(Al3+)+c(H+),2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=(10-3-10-11)mol•L-1,
故答案为:10-3-10-11;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,a点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
点评 本题考查了离子浓度大小比较、盐类水解等知识点,题目难度中等,离子浓度大小比较常常与盐类水解、弱电解质的电离联合考查,确定离子浓度大小时要结合电荷守恒、物料守恒来分析解答,难点是(3)题,知道图象中各个点的溶质即可解答.

| A. | 用托盘天平称取5.85g氯化钠固体 | |
| B. | 提取碘水中的碘单质时,可选用酒精作萃取剂 | |
| C. | 观察钾元素焰色反应的操作是:将铂丝在稀盐酸中洗涤后直接蘸取固体氯化钾,置于酒精灯火焰上进行灼烧,根据火焰是否显紫色来确定 | |
| D. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| A. | 单质钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 纯碱溶液与盐酸反应:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| C. | 氢氧化铜与盐酸反应:H++OH-═H2O | |
| D. | 稀硫酸和氢氧化钡溶液反应:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O |
| A. | 混合气的压强不变 | |
| B. | 混合气的体积不变 | |
| C. | 混合气的密度不变 | |
| D. | 有n个H-H键断裂的同时有2n个H-I键断裂 |
| A. | 稀硫酸与氢氧化钡反应:Ba2++SO42-═BaSO4↓ | |
| B. | 铁和稀盐酸:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化铜溶于稀硫酸:Cu(OH)2+2H+═2H2O+Cu2+ | |
| D. | 盐酸与石灰石溶液反应:CO32-+2H+═H2O+CO2↑ |
| A. | 加入硝酸酸化的硝酸钡溶液 | B. | 先加硝酸酸化,再加入硝酸钡溶液 | ||
| C. | 加盐酸酸化了的BaCl2溶液 | D. | 先加盐酸酸化,再加入BaCl2溶液 |
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO•Cr2O3)利用以下过程来制取.
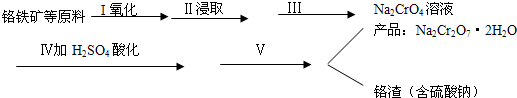
①步骤I中反应的化学方程式为:
4FeO•Cr2O3(s)+8Na2CO3(s)+7O2=8Na2Cro4(s)+2Fe2O3+8CO2该反应的化学平衡常数的表达式为K=$\frac{c(C{O}_{2})^{8}}{c({O}_{2})^{7}}$,在常温下该反应速度极慢,下列措施中能使反应速率增大的是ABC.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是NaA1O2[或NaA1(OH)4]、Na2SiO3.
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是除去A1O-2、SiO32-等杂质.
④步骤Ⅳ中发生反应的离子方程式为:2CrO42-+2H+=Cr2O72-+H2O.
(2)将红矾钠与KCl固体按1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体.请填写表中空格,完成上述过程.(已知:在室温下重铬酸钾溶解度很小,而在升高温度时,其溶解度大大增加).
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中,加入热的蒸馏水,充分搅拌直到固体不再溶解. |
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
 向Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入NaOH体积V之间的关系如图所示.则混合溶液中Al2(SO4)3和MgSO4的物质的量之比为1:2.
向Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入NaOH体积V之间的关系如图所示.则混合溶液中Al2(SO4)3和MgSO4的物质的量之比为1:2.