题目内容
20.下列反应中,反应物量的相对多少都会影响反应产物,下列离子方程式正确的是( )| A. | 少量CO2通入过量氨水中:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 含等物质的量的NH4HSO3与NaOH溶液混合加热:HSO3-+OH-$\frac{\underline{\;△\;}}{\;}$SO32-+H2O | |
| C. | 溴化亚铁溶液中通入少量Cl2:Cl2+2Br-═2Cl-+Br2 | |
| D. | 含1molKOH的溶液与含2molBa(HCO3)2的溶液混合:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O |
分析 A.氨水过量,反应生成碳酸铵;
B.亚硫酸氢根离子结合氢氧根离子能力大于铵根离子,氢氧化钠不足,亚硫酸氢根离子优先反应;
C.氯气少量,亚铁离子还原性较强,则亚铁离子优先反应,溴离子不反应;
D.1molKOH的溶液与含2molBa(HCO3)2的溶液混合,氢氧化钾不足,碳酸根离子完全转化成碳酸钡沉淀.
解答 解:A.少量CO2通入过量氨水中,反应生成碳酸铵,正确的离子方程式为:2NH3•H2O+CO2═2NH4++H2O+CO32-,故A错误;
B.含等物质的量的NH4HSO3与NaOH溶液混合加热,氢氧化钠不足,只有亚硫酸氢根离子反应,反应的离子方程式为HSO3-+OH-$\frac{\underline{\;△\;}}{\;}$SO32-+H2O,故B正确;
C.溴化亚铁溶液中通入少量Cl2,亚铁离子优先反应,正确的离子方程式为Cl2+2Fe2+═2Fe3++2Cl-,故C错误;
D.含1molKOH的溶液与含2molBa(HCO3)2的溶液混合,氢氧化钾不足,离子方程式按照氢氧化钾的化学式书写,正确的离子方程式为:Ba2++HCO3-+OH-═BaCO3↓+H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
10.下列关于玻璃的叙述正确的是( )
| A. | 制普通玻璃的主要是纯碱、石灰石、石英 | |
| B. | 普通玻璃的成分主要是硅酸钠和二氧化硅 | |
| C. | 玻璃是几种成分熔化在一起的晶体 | |
| D. | 玻璃是硅酸钠盐,有一定的熔点 |
11.在恒温容器中,可逆反应H2(g)+I2(g)?2HI(g)一定达平衡状态的是( )
| A. | 混合气的压强不变 | |
| B. | 混合气的体积不变 | |
| C. | 混合气的密度不变 | |
| D. | 有n个H-H键断裂的同时有2n个H-I键断裂 |
15.检验未知溶液中是否含有SO${\;}_{4}^{2-}$,下列操作中最合理的是( )
| A. | 加入硝酸酸化的硝酸钡溶液 | B. | 先加硝酸酸化,再加入硝酸钡溶液 | ||
| C. | 加盐酸酸化了的BaCl2溶液 | D. | 先加盐酸酸化,再加入BaCl2溶液 |
3.红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛.
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO•Cr2O3)利用以下过程来制取.
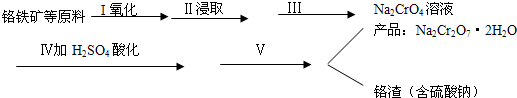
①步骤I中反应的化学方程式为:
4FeO•Cr2O3(s)+8Na2CO3(s)+7O2=8Na2Cro4(s)+2Fe2O3+8CO2该反应的化学平衡常数的表达式为K=$\frac{c(C{O}_{2})^{8}}{c({O}_{2})^{7}}$,在常温下该反应速度极慢,下列措施中能使反应速率增大的是ABC.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是NaA1O2[或NaA1(OH)4]、Na2SiO3.
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是除去A1O-2、SiO32-等杂质.
④步骤Ⅳ中发生反应的离子方程式为:2CrO42-+2H+=Cr2O72-+H2O.
(2)将红矾钠与KCl固体按1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体.请填写表中空格,完成上述过程.(已知:在室温下重铬酸钾溶解度很小,而在升高温度时,其溶解度大大增加).
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO•Cr2O3)利用以下过程来制取.

①步骤I中反应的化学方程式为:
4FeO•Cr2O3(s)+8Na2CO3(s)+7O2=8Na2Cro4(s)+2Fe2O3+8CO2该反应的化学平衡常数的表达式为K=$\frac{c(C{O}_{2})^{8}}{c({O}_{2})^{7}}$,在常温下该反应速度极慢,下列措施中能使反应速率增大的是ABC.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是NaA1O2[或NaA1(OH)4]、Na2SiO3.
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是除去A1O-2、SiO32-等杂质.
④步骤Ⅳ中发生反应的离子方程式为:2CrO42-+2H+=Cr2O72-+H2O.
(2)将红矾钠与KCl固体按1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体.请填写表中空格,完成上述过程.(已知:在室温下重铬酸钾溶解度很小,而在升高温度时,其溶解度大大增加).
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中,加入热的蒸馏水,充分搅拌直到固体不再溶解. |
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
1.配制100mL浓度为2mol/L NaOH溶液过程中,下列部分实验操作正确的是( )
| A. | 称取8g NaOH固体放入烧杯中,加入100 mL蒸馏水,并不断搅拌至固体溶解 | |
| B. | 称取8g NaOH固体,放入100 mL容量瓶中,加入蒸馏水使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| C. | 称取8 g NaOH固体,放入100 mL量筒中,加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL | |
| D. | 称取8g NaOH固体放入烧杯中,加入适量蒸馏水溶解,冷却后将烧杯中溶液注入100 mL容量瓶后,用少量蒸馏水洗涤烧杯内壁2~3次 |
 向Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入NaOH体积V之间的关系如图所示.则混合溶液中Al2(SO4)3和MgSO4的物质的量之比为1:2.
向Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入NaOH体积V之间的关系如图所示.则混合溶液中Al2(SO4)3和MgSO4的物质的量之比为1:2.