题目内容
13.X、Y、Z、M、N是短周期元素,且原子序数依次递增.已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大.Z和N可以形成ZN2型化合物.回答下列问题:(1)元素N在周期表中的位置第三周期第ⅤⅡA族,它的最高价氧化物的化学式为Cl2O7.
(2)由元素X、Y形成的一种化合物可以作为呼吸面具的供氧剂,该化合物的化学键类型为离子键和非极性键,用电子式表示该化合物的形成过程
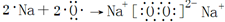 .
.(3)写出Y、M两种元素对应的最高价氧化物的水化物相互反应的离子方程式H++OH-═H2O.
(4)Z能在氮气中燃烧,Z在氮气中燃烧的产物与水反应可产生一种使湿润红色石蕊试纸变蓝的气体.写出Z在氮气中的燃烧产物与盐酸反应的化学方程式:Mg3N2+8HCl=3MgCl2+2NH4Cl.
分析 X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增,X原子的最外层电子数是次外层电子数的3倍,则原子核各层电子分别为2、6,故X为O元素,X、M同主族,则M为S元素,Y在同周期主族元素中原子半径最大,故Y、Z、M、N处于第三周期,Y为Na元素,N为Cl元素,Z和Cl可以形成ZCl2型化合物,Z为+2价,故Z为Mg元素,结合对应的单质化合物的性质与元素周期律的递变规律解答.
解答 解:X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增,X原子的最外层电子数是次外层电子数的3倍,则原子核各层电子分别为2、6,故X为O元素,X、M同主族,则M为S元素,Y在同周期主族元素中原子半径最大,故Y、Z、M、N处于第三周期,Y为Na元素,N为Cl元素,Z和Cl可以形成ZCl2型化合物,Z为+2价,故Z为Mg元素,
(1)N为Cl元素,在周期表中的位置是第三周期第ⅤⅡA族,Cl的最高价氧化物的化学式为Cl2O7,
故答案为:第三周期第ⅤⅡA族;Cl2O7;
(2)由元素X、Y形成的一种化合物可以作为呼吸面具的供氧剂,该化合物为过氧化钠,过氧化钠中含有的化学键类型为离子键和非极性键,用电子式表示过氧化钠的形成过程为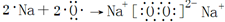 ,
,
故答案为:离子键和非极性键;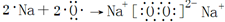 ;
;
(3)M为S元素,Y为Na元素,Y、M两种元素对应的最高价氧化物的水化物分别为硫酸和氢氧化钠,它们相互反应的离子方程式为H++OH-═H2O,
故答案为:H++OH-═H2O;
(4)镁能在氮气中燃烧,生成氮化镁,氮化镁与水反应可产生一种使湿润红色石蕊试纸变蓝的气体为氨气,则氮化镁与盐酸反应的化学方程式为Mg3N2+8HCl=3MgCl2+2NH4Cl,
故答案为:Mg3N2+8HCl=3MgCl2+2NH4Cl.
点评 本题考查元素的推断以及元素化合物知识,注意把握原子的结构特点,结合元素周期律知识进行推断,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体也从下口放出 | |
| B. | 钠保存在煤油中 | |
| C. | 用洁净的铂丝蘸取某溶液在酒精灯火焰上灼烧时,火焰呈黄色,说明原溶液中含有Na+ | |
| D. | 可用CCl4萃取溴水中的溴单质 |
| A. | 金属钠的制取:2NaCl(熔融)$\stackrel{通直流电}{→}$2Na+C12↑ | |
| B. | 金属镁的制取:MgO+CO$\stackrel{加热}{→}$Mg+CO2 | |
| C. | 金属铬的制取:Cr2O3+2Al$\stackrel{高温}{→}$2Cr+Al2O3 | |
| D. | 金属汞的制取:2HgO$\stackrel{加热}{→}$2Hg+O2↑ |
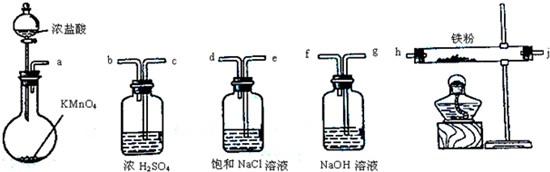
| A. | a-b-c-d-e-e-f-g-h | B. | a-e-d-c-b-h-j-g | ||
| C. | a-d-e-c-b-h-j-g | D. | a-c-b-d-e-h-j-f |
| A. | 它只有一种氧化物Cs2O | B. | 它与水剧烈反应 | ||
| C. | Cs+具有很强的氧化性 | D. | CsHCO3受热不易分解 |
 向Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入NaOH体积V之间的关系如图所示.则混合溶液中Al2(SO4)3和MgSO4的物质的量之比为1:2.
向Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入NaOH体积V之间的关系如图所示.则混合溶液中Al2(SO4)3和MgSO4的物质的量之比为1:2.