题目内容
18.下列反应的离子方程式正确的是( )| A. | Na与H2O反应:Na+H2O═Na++OH-+H2↑ | |
| B. | Cu与浓硫酸:Cu+2H+═Cu2++H2↑ | |
| C. | Fe能溶于FeCl3溶液:Fe+Fe3+═2Fe2+ | |
| D. | SiO2与NaOH溶液:SiO2+2OH-═SiO32-+H2O |
分析 A.电子、电荷不守恒;
B.反应生成硫酸铜、二氧化硫和水;
C.电子、电荷不守恒;
D.反应生成硅酸钠和水.
解答 解:A.Na与H2O反应的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.Cu与浓硫酸反应的离子反应为Cu+2H2SO4(浓)═SO42-+Cu2++SO2↑+2H2O,故B错误;
C.Fe能溶于FeCl3溶液的离子反应为Fe+2Fe3+═3Fe2+,故C错误;
D.SiO2与NaOH溶液的离子反应为SiO2+2OH-═SiO32-+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.复印机工作时易产生臭氧,臭氧浓度过高时对人体有害.臭氧具有强氧化性,可使润湿的KI-淀粉试纸变蓝.有关反应式为:O3+2KI+H2O═2KOH+I2+O2对此下列说法正确的是( )
| A. | 反应中1 mol O3得到4 mol电子 | |
| B. | 反应中O3是氧化剂,H2O与KI是还原剂 | |
| C. | 氧化产物I2与还原产物KOH的物质的量之比是1:1 | |
| D. | 由此反应知,氧化性强弱顺序是O3>I2>O2 |
9.喷水溶液法是科学家近期研制出的一种使沙漠变绿洲的新技术.它是先在沙漠中喷洒一定量的聚丙烯酸酯(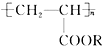 )“水溶液”,“水溶液”中的高分子化合物与沙土粒子相结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,既能阻止地下的盐分上升,又有拦截蓄积雨水的作用.下列关于聚丙烯酸酯的说法中,不正确的是( )
)“水溶液”,“水溶液”中的高分子化合物与沙土粒子相结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,既能阻止地下的盐分上升,又有拦截蓄积雨水的作用.下列关于聚丙烯酸酯的说法中,不正确的是( )
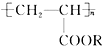 )“水溶液”,“水溶液”中的高分子化合物与沙土粒子相结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,既能阻止地下的盐分上升,又有拦截蓄积雨水的作用.下列关于聚丙烯酸酯的说法中,不正确的是( )
)“水溶液”,“水溶液”中的高分子化合物与沙土粒子相结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,既能阻止地下的盐分上升,又有拦截蓄积雨水的作用.下列关于聚丙烯酸酯的说法中,不正确的是( )| A. | 合成它的小分子化合物是CH3-CH2-COOR | |
| B. | 它可由CH2═CH-COOR经过加成聚合反应而得到 | |
| C. | 在一定条件下能发生水解反应 | |
| D. | 不能发生加成反应 |
13.下列实验操作或描述中正确的是( )
| A. | 用托盘天平称取5.85g氯化钠固体 | |
| B. | 提取碘水中的碘单质时,可选用酒精作萃取剂 | |
| C. | 观察钾元素焰色反应的操作是:将铂丝在稀盐酸中洗涤后直接蘸取固体氯化钾,置于酒精灯火焰上进行灼烧,根据火焰是否显紫色来确定 | |
| D. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
3.下列操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体也从下口放出 | |
| B. | 钠保存在煤油中 | |
| C. | 用洁净的铂丝蘸取某溶液在酒精灯火焰上灼烧时,火焰呈黄色,说明原溶液中含有Na+ | |
| D. | 可用CCl4萃取溴水中的溴单质 |
10.下列关于玻璃的叙述正确的是( )
| A. | 制普通玻璃的主要是纯碱、石灰石、石英 | |
| B. | 普通玻璃的成分主要是硅酸钠和二氧化硅 | |
| C. | 玻璃是几种成分熔化在一起的晶体 | |
| D. | 玻璃是硅酸钠盐,有一定的熔点 |
7.下列电离方程式中书写正确的是( )
| A. | NaHSO4?Na++H++SO42- | B. | H2S?H++HS-、HS-?H++S2- | ||
| C. | HClO=H++ClO- | D. | NaHCO3?Na++H++CO32- |
 向Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入NaOH体积V之间的关系如图所示.则混合溶液中Al2(SO4)3和MgSO4的物质的量之比为1:2.
向Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入NaOH体积V之间的关系如图所示.则混合溶液中Al2(SO4)3和MgSO4的物质的量之比为1:2.