题目内容
5.下列叙述正确的有( )①化学键只存在分子之内
②离子化合物中不可能含非极性键
③共价化合物中不可能含离子键
④由非金属元素形成的化合物都是共价化合物
⑤强电解质一定是离子化合物
⑥共价化合物可以是非电解质
⑦稳定性:H2O>H2S,跟氢键有关.
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
分析 ①化学键为相邻原子间强烈的相互作用,包括共价键和离子键,氢键和范德华力不属于化学键;
②离子化合物过氧化钠含非极性键;
③共价化合物仅有共价键形成的化合物;
④氯化铵由非金属元素形成的化合物,是离子化合物;
⑤氯化氢是强电解质但是共价化合物;
⑥二氧化碳、氨气是共价化合物也是非电解质;
⑦稳定性:H2O>H2S,与氧与硫元素的非金属性有关;由此分析解答.
解答 解:①化学键为相邻原子间强烈的相互作用,包括共价键和离子键,氢键和范德华力不属于化学键,还可存在阴阳离子之间和自由电子与金属阳离子之间,故错误;
②离子化合物过氧化钠含非极性键,所以离子化合物中可能含非极性键,故错误;
③共价化合物仅有共价键形成的化合物,故正确;
④氯化铵由非金属元素形成的化合物,是离子化合物,故错误;
⑤氯化氢是强电解质但是共价化合物,故错误;
⑥二氧化碳、氨气是共价化合物也是非电解质,故正确;
⑦稳定性:H2O>H2S,与氧与硫元素的非金属性有关,与氢键无关,故错误;
所以只有③⑥正确,故选A.
点评 本题考查化学键,为基础性习题,把握化学键的概念及化学键的形成为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.关于元素周期表中元素分布的描述,正确的是( )
| A. | 周期表中的主族都有非金属元素 | |
| B. | 周期表中的主族都有金属元素 | |
| C. | 周期表中的金属元素都位于长周期 | |
| D. | 周期表中的非金属元素都位于主族和0族 |
16.C8H8O2符合下列要求的同分异构体种类( )
①属于芳香族化合物②能与新制氢氧化铜溶液反应③能与氢氧化钠溶液反应.
①属于芳香族化合物②能与新制氢氧化铜溶液反应③能与氢氧化钠溶液反应.
| A. | 10 | B. | 21 | C. | 14 | D. | 17 |
13.25℃时,浓度均为0.1mol/L的溶液,其pH如下表所示.有关说法正确的是( )
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A. | 酸性强弱:H2CO3>HF | |
| B. | ①和②中溶质均未水解 | |
| C. | 离子的总浓度:①>③ | |
| D. | ④中:c(HCO3-)+2c(CO32-)+c(H2CO3)═0.1 mol/L |
10.下列说法正确的是( )
| A. | IA族元素的金属性比IIA族元素的金属性强 | |
| B. | 第三周期元素的离子半径从左到右逐渐减小 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增加 | |
| D. | VIA族元素的氢化物中,稳定性最好的其沸点也最高 |
17.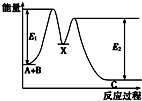 反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E4表示反应A+B→X的活化能,下列有关叙述正确的是( )
反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E4表示反应A+B→X的活化能,下列有关叙述正确的是( )
 反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E4表示反应A+B→X的活化能,下列有关叙述正确的是( )
反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E4表示反应A+B→X的活化能,下列有关叙述正确的是( )| A. | Ee表示反应X→C的活化能 | |
| B. | X是反应A+B→C的催化剂 | |
| C. | 反应A+B→C的△H<0 | |
| D. | 加入催化剂可改变反应A+B→C的焓变 |
14.下列根据实验操作和现象所得出的结论正确的是下列根据实验操作和现象所得出的结论正确的是
( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中一定含有SO42- |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中, 再滴加CCl4,振荡、静置,向上层溶液中滴 加KSCN溶液.再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红, 下层溶液紫红色 实验现象2: 上层溶液变红 | 氧化性: Br2>Fe3+>I2 |
| C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| D | 浓度相同的ZnCl2、CuCl2溶液中,滴入少量Na2S溶液 | 只有黑色沉淀 | Ksp(CuS)>Ksp(ZnS) |
| A. | A | B. | B | C. | C | D. | D |

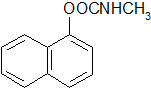 )的流程如下:
)的流程如下: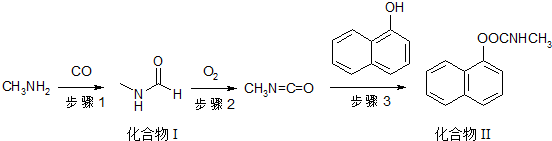
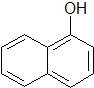 ),所需的试剂是氯化铁溶液或浓溴水.T℃,a mol/L萘酚溶液的pH=b,则该温度下萘酚的电离平衡常数K=$\frac{1{0}^{-2b}}{a-1{0}^{-b}}$.
),所需的试剂是氯化铁溶液或浓溴水.T℃,a mol/L萘酚溶液的pH=b,则该温度下萘酚的电离平衡常数K=$\frac{1{0}^{-2b}}{a-1{0}^{-b}}$.