题目内容
10.下列说法正确的是( )| A. | IA族元素的金属性比IIA族元素的金属性强 | |
| B. | 第三周期元素的离子半径从左到右逐渐减小 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增加 | |
| D. | VIA族元素的氢化物中,稳定性最好的其沸点也最高 |
分析 A.同周期,从左向右金属性减弱;
B.第三周期元素的阴离子,具有相同电子层结构,原子序数大的离子半径小;
C.同周期非金属元素最高价氧化物对应的水化物的酸性从左到右依次增加;
D.非金属性越强,气态氢化物越稳定,分子间含有氢键的沸点较高.
解答 解:A.由元素周期律可知,同周期的IA族元素的金属性比IIA族的元素金属性强,故A错误;
B.第三周期元素的阴离子,具有相同电子层结构,则第三周期元素的阴离子半径从左到右逐渐减小,故B错误;
C.同周期非金属元素最高价氧化物对应的水化物的酸性从左到右依次增加,不是最高价氧化物的水化物的酸性没有规律,故C错误;
D.VIA族元素中O的非金属性最强,氢化物中稳定性最好的是H2O,H2O分子间含有氢键,沸点最高,故D正确;
故选D.
点评 本题考查同主族、同周期元素性质及元素化合物性质,为高频考点,把握同主族、同周期的位置关系及非金属性比较为解答的关键,选项D为易错点,注意特例应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.一定条件下,在密闭容器中,能表示反应X(g)+3Y(g)?2Z(g) 一定达到化学平衡状态的是( )
| A. | X、Y、Z的物质的量之比为1:3:2 | |
| B. | X、Y、Z的浓度不再发生变化 | |
| C. | 单位时间内生成2n mol Z,同时消耗3n mol Y | |
| D. | 单位时间内消耗n mol X,同时消耗3n mol Y |
1.下列反应不属于取代反应的是( )
| A. | 溴乙烷与氢氧化钠水溶液共热 | |
| B. | 溴乙烷与氧氧化钠的乙醇溶液共热 | |
| C. | 甲烷与氯气反应 | |
| D. | 乙炔与氯化氢在一定条件下制氯乙烯 |
18.还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
2CrO${\;}_{4}^{2-}$$\underset{\stackrel{{H}^{+}}{→}}{转换}$Cr2O${\;}_{7}^{2-}$$\underset{\stackrel{F{e}^{2+}}{→}}{还原}$Cr3+$\underset{\stackrel{O{H}^{-}}{→}}{沉淀}$Cr(OH)3↓
已知转化过程中的反应为2CrO${\;}_{4}^{2-}$(aq)+2H+(aq)?Cr2O${\;}_{7}^{2-}$(aq)+H2O(l)
,转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2072-,下列说法不正确的是( )
2CrO${\;}_{4}^{2-}$$\underset{\stackrel{{H}^{+}}{→}}{转换}$Cr2O${\;}_{7}^{2-}$$\underset{\stackrel{F{e}^{2+}}{→}}{还原}$Cr3+$\underset{\stackrel{O{H}^{-}}{→}}{沉淀}$Cr(OH)3↓
已知转化过程中的反应为2CrO${\;}_{4}^{2-}$(aq)+2H+(aq)?Cr2O${\;}_{7}^{2-}$(aq)+H2O(l)
,转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2072-,下列说法不正确的是( )
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeS04•7H2O)作还原剂,处理1 L废水,至少需要458.7g | |
| C. | 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
5.下列叙述正确的有( )
①化学键只存在分子之内
②离子化合物中不可能含非极性键
③共价化合物中不可能含离子键
④由非金属元素形成的化合物都是共价化合物
⑤强电解质一定是离子化合物
⑥共价化合物可以是非电解质
⑦稳定性:H2O>H2S,跟氢键有关.
①化学键只存在分子之内
②离子化合物中不可能含非极性键
③共价化合物中不可能含离子键
④由非金属元素形成的化合物都是共价化合物
⑤强电解质一定是离子化合物
⑥共价化合物可以是非电解质
⑦稳定性:H2O>H2S,跟氢键有关.
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
20.某化学小组用如图所列装置(固定装置略)验证CO能还原CuO,并探究其还原产物的组成.
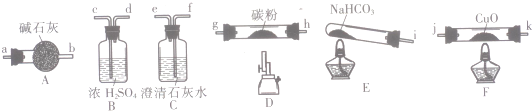
请回答:
(1)按气流方向,各装置从左到右的连接顺序为:i→cd→gh或hg→ab→jk或kj→fe尾气处理(填仪器接口的字母编号).
(2)说明CO能还原CuO的实验现象为F处硬质玻璃管中的黑色固体变为红色,C处澄清石灰水变浑浊.
(3)该实验处理尾气的方法为点燃烧掉或用气囊收集.
(4)若去掉B装置,可能产生的影响为NaHCO3分解产生的水蒸气高温能与碳粉反应生成H2,对实验产生干扰.
(5)将各装置按正确的顺序连接后进行实验.当反应结束后,F处硬质玻璃管中的固体全部变为红色.
[查阅资料]Cu和Cu2O均为红色;Cu2O在酸性溶液中能生成Cu和Cu2+.
[提出猜想]红色固体的成分可能为:①Cu;②Cu2O;③Cu和Cu2O.
[实验验证]该小组为验证上述猜想,分别取少量红色固体放人试管中,进行如下实验.
[实验评价]根据上述实验,不能确定红色固体成分的实验是a(填实验编号),理由为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O、3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O.(用化学方程式表示).
[实验结论]根据上述实验结果,可知红色固体的成分为Cu(填化学式).

请回答:
(1)按气流方向,各装置从左到右的连接顺序为:i→cd→gh或hg→ab→jk或kj→fe尾气处理(填仪器接口的字母编号).
(2)说明CO能还原CuO的实验现象为F处硬质玻璃管中的黑色固体变为红色,C处澄清石灰水变浑浊.
(3)该实验处理尾气的方法为点燃烧掉或用气囊收集.
(4)若去掉B装置,可能产生的影响为NaHCO3分解产生的水蒸气高温能与碳粉反应生成H2,对实验产生干扰.
(5)将各装置按正确的顺序连接后进行实验.当反应结束后,F处硬质玻璃管中的固体全部变为红色.
[查阅资料]Cu和Cu2O均为红色;Cu2O在酸性溶液中能生成Cu和Cu2+.
[提出猜想]红色固体的成分可能为:①Cu;②Cu2O;③Cu和Cu2O.
[实验验证]该小组为验证上述猜想,分别取少量红色固体放人试管中,进行如下实验.
| 实验编号 | 操作 | 现象 |
| a | 加入足量稀硝酸、振荡 | 试管内红色固体完全溶解,溶液变为蓝色,并有无色气体产生 |
| b | 加入足量稀硫酸、振荡 | 试管内有红色固体,溶液为无色 |
[实验结论]根据上述实验结果,可知红色固体的成分为Cu(填化学式).
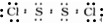 .
.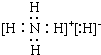 .
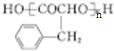
. 是一种环保型的新涂料,其合成路线如下图所示:
是一种环保型的新涂料,其合成路线如下图所示:
 .
. .
. .
.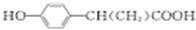 (写出其中一种的结构简式).
(写出其中一种的结构简式).
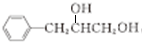 ,试剂G的化学式H2.
,试剂G的化学式H2.