题目内容
14.下列根据实验操作和现象所得出的结论正确的是下列根据实验操作和现象所得出的结论正确的是| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中一定含有SO42- |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中, 再滴加CCl4,振荡、静置,向上层溶液中滴 加KSCN溶液.再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红, 下层溶液紫红色 实验现象2: 上层溶液变红 | 氧化性: Br2>Fe3+>I2 |
| C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| D | 浓度相同的ZnCl2、CuCl2溶液中,滴入少量Na2S溶液 | 只有黑色沉淀 | Ksp(CuS)>Ksp(ZnS) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.白色沉淀可能为AgCl;
B.由现象可知少量的溴水只氧化碘离子,再向上层溶液中滴加KSCN溶液后滴加溴水溶液变红可知,溴水氧化亚铁离子;
C.过氧化钠与盐酸反应生成氧气;
D.滴入少量Na2S溶液,Ksp小的先转化为沉淀.
解答 解:A.由操作和现象可知白色沉淀可能为AgCl或硫酸钡,则原溶液中可能含银离子或SO42-,但二者不能同时存在,故A错误;
B.由现象可知少量的溴水只氧化碘离子,再向上层溶液中滴加KSCN溶液后滴加溴水溶液变红可知,溴水氧化亚铁离子,由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性为Br2>Fe3+>I2,故B正确;
C.过氧化钠与盐酸反应生成氧气,变质生成碳酸钠与盐酸反应生成二氧化碳,均为无色气体,则现象不能说明是否变质,故C错误;
D.滴入少量Na2S溶液,Ksp小的先转化为沉淀,则生成黑色沉淀可知Ksp(CuS)<Ksp(ZnS),故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及离子检验、氧化还原反应、物质的性质及沉淀生成等,把握物质的性质、反应原理为解答的关键,侧重元素化合物知识及化学反应原理的综合应用能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
4.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是( )
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热 | |
| C. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 | |
| D. | 甲醇在铜催化和加热条件下生成的产物 |
5.下列叙述正确的有( )
①化学键只存在分子之内
②离子化合物中不可能含非极性键
③共价化合物中不可能含离子键
④由非金属元素形成的化合物都是共价化合物
⑤强电解质一定是离子化合物
⑥共价化合物可以是非电解质
⑦稳定性:H2O>H2S,跟氢键有关.
①化学键只存在分子之内
②离子化合物中不可能含非极性键
③共价化合物中不可能含离子键
④由非金属元素形成的化合物都是共价化合物
⑤强电解质一定是离子化合物
⑥共价化合物可以是非电解质
⑦稳定性:H2O>H2S,跟氢键有关.
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
3.实验室用锌粒与20ml浓度为2mol/L的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,下列关于化学反应速率说法正确的是( )
| A. | 少量NaNO3固体,v(H2)减小 | B. | 20mL BaCl2溶液,v(H2)不变 | ||
| C. | 少量NaHSO4固体,v(H2)不变 | D. | 改用18mol/L的硫酸,v(H2)增大 |
4.关于下列各图象的说法中正确的是( )


| A. | 图①表示防止铁腐蚀的装置图 | |
| B. | 图②表示向BaSO4饱和溶液中加入硫酸钠 | |
| C. | 图③表示将NaOH溶液滴入Ba(HCO3)3溶液中 | |
| D. | 图④表示反应物的总键能大于生成物的总键能 |
 是一种环保型的新涂料,其合成路线如下图所示:
是一种环保型的新涂料,其合成路线如下图所示:
 .
.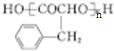 .
. .
.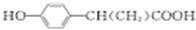 (写出其中一种的结构简式).
(写出其中一种的结构简式).
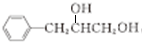 ,试剂G的化学式H2.
,试剂G的化学式H2. .
.