题目内容
5.燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液.(1)完成下列关于甲烷(CH4)燃料电池的填空:
①甲烷与氧气反应的化学方程式为:CH4+O2═CO2+2H2O
②已知燃料电池的总反应式为CH4+2O2+2KOH═K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-═CO32-+7H2O,这个电极是燃料电池的负极(填“正极”或“负极”),另一个电极上的电极反应式为:2O2+4H2O+8e-═8OH-
③随着电池不断放电,电解质溶液的碱性减小(填“增大”、“减小”或“不变”)
④通常情况下,甲烷燃料电池的能量利用率大于(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
(2)据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次.假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
①该电池反应的总离子方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O
②甲醇在负极极发生反应(填正或负),电池在放电过程中溶液的pH将较低(填降低或上升、不变).
分析 (1)①该燃料电池中,甲烷和氧气反应生成二氧化碳和水;
②燃料电池中,通入燃料的电极是负极,通入氧化剂的电极是正极,碱性条件下,正极上氧气得电子和水反应生成氢氧根离子;
③根据电池反应式知,随着反应的进行,溶液中KOH参加反应导致浓度降低;
④燃料电池中大部分化学能转化为电能,燃料燃烧时,很多化学能转化为热能、光能等;
(2)①甲醇燃料碱性电池中,甲醇和碱反应生成碳酸根离子和水;
②负极上甲醇失电子发生氧化反应,根据电池反应式中氢氧根离子浓度变化判断pH变化.
解答 解:(1)①该燃料电池中,甲烷和氧气反应生成二氧化碳和水,反应方程式为CH4+2O2=CO2+2H2O,故答案为:CH4+2O2=CO2+2H2O;
②CH4+10OH--8e-═CO32-+7H2O中C元素化合价由-4价变为+4价,所以甲烷失电子发生氧化反应,其所在电极为负极,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为2O2+4H2O+8e-═8OH-,故答案为:负极;2O2+4H2O+8e-═8OH-;
③该燃料电池电池反应式为CH4+10OH--8e-═CO32-+7H2O,氢氧根离子参加反应,所以反应过程中氢氧根离子浓度减小,溶液的pH减小,故答案为:减小.
④燃料电池中大部分化学能转化为电能,燃料燃烧时,很多化学能转化为热能、光能等,所以燃料燃烧能量利用率较低,故答案为:大于;
(2)①甲醇燃料碱性电池中,甲醇和碱反应生成碳酸根离子和水,离子反应方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O,
故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
②负极上甲醇失电子发生氧化反应,根据电池反应式知,氢氧根离子参加反应导致溶液中氢氧根离子浓度降低,所以溶液的pH下降,故答案为:负;降低.
点评 本题考查化学电源新型电池,为高频考点,所有的燃料电池中负极通入燃料、正极通入氧化剂,但电解质有酸性溶液、碱性溶液、熔融盐或熔融氧化物类型,难点是电极反应式的书写.

| A. | 反应产物的总焓与反应物的总焓之差,称为反应焓变 | |
| B. | 反应产物的总焓小于反应物的总焓,该反应为吸热反应 | |
| C. | 同一反应在不同温度下进行,其焓变是不同的 | |
| D. | 已知2NO2(g)═N2O4(g)△H1,N2O4(g)═2NO2(g)△H2,则△H1=-△H2 |
| A. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| B. | 硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═CO2↑+2H2O | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 当由铜、锌电极与硫酸铜溶液组成原电池时,铜是负极 | |
| C. | 负极反应为:2H++2e-═H2↑ | |
| D. | 该装置能将化学能转化为电能 |
| A. | 晶体硅是将太阳能转化为电能的常用材料 | |
| B. | 用加热的方法杀死H7N9禽流感病毒是采用了蛋白质变性原理 | |
| C. | “克隆羊”的关键技术之一是找到一些激活普通细胞的酶,并将它浸泡在酒精中保存 | |
| D. | 钠钾合金在常温下呈液态,可用于快中子反应堆作热交换剂 |
| A. | 常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5NA | |
| B. | 1 mol Na2O2与足量的水反应,转移的电子数为2NA | |
| C. | NA 个SO3分子在标准状况下的体积为22.4 L | |
| D. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
| A. | 向10ml 0.1mol•L-1NH4HSO4溶液中滴加10ml 0.1mol•L-1NaOH溶液:2c(SO42-)═c(NH4+)+c(NH3•H2O) | |
| B. | 等体积等浓度NaHCO3溶液和Na2CO3溶液混合:$\frac{C(HC{O}_{3}^{-})}{C({H}_{2}C{O}_{3})}$<$\frac{C(C{O}_{3}^{2-})}{C(HC{O}_{3}^{-})}$ | |
| C. | 物质的量浓度均为0.1mol•L-1Na2S溶液、NaHS溶液等体积混合所得溶液中:2c(OH--)-2c(H+)═3 c(H2S)+c(HS--)-c(S2--) | |
| D. | 将足量的AgCl分别放入:①5 ml水 ②10 ml 0.2mol•L-1MgCl2溶液③20ml0.3mol•L-1盐酸中溶解至饱和,c(Ag+):①>②>③ |
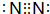 .
.