题目内容
15.我们已经知道了许许多多的物质,如氯化钠、氧化镁、硫酸铜、碳酸钙、金属钠、氯气、氢气、氧气、硫酸、金属铜、硫单质、液氮、二氧化硫、硫酸钙、氯化铁、硝酸钾、二氧化氮、氨气、二氧化硅、碘化钾等.(1)请从多个角度对这些物质进行分类,并说出你的分类标准.
(2)再举出一些你知道的各类别的具体物质.
分析 (1)可以从单质(金属单质和非金属单质)、氧化物(金属氧化物和非金属氧化物)、酸、碱、盐;固、液、气三态等角度对物质进行分类.
(2)根据树状分类,结合物质类别列举相应的物质.
解答 解:(1)可以从单质(金属单质和非金属单质)分类,为金属钠、金属铜为金属单质,氯气、氢气、氧气、硫单质、液氮为非金属单质;若从氧化物分类,可以分为金属氧化物如氧化镁、和非金属氧化物如二氧化硫、二氧化氮、二氧化硅等;
酸、碱、盐分类,氯化钠、硫酸铜、碳酸钙、硫酸钙、氯化铁、硝酸钾、碘化钾等为盐,硫酸为酸;
固、液、气三态等角度对物质进行分类,氯化钠、氧化镁、硫酸铜、碳酸钙、金属钠、金属铜、硫单质、硫酸钙、氯化铁、硝酸钾、二氧化硅、碘化钾为固体,硫酸、液氮为液体;二氧化硫、氯气、氢气、氧气、二氧化氮、氨气为气体,
故答案为:可以从单质(金属单质和非金属单质)、氧化物(金属氧化物和非金属氧化物)、酸、碱、盐;固、液、气三态等角度对物质进行分类;
(2)根据树状分类,结合物质类别列举相应的物质,单质有铁、铝、金、碳、稀有气体等;化合物有酸、碱、盐、氧化物,酸有醋酸,硝酸、碳酸等,碱如氢氧化钠,氢氧化钙、氢氧化钾、一水合氨等;盐有硫酸亚铁、硫化钠等,氧化物有二氧化碳、一氧化碳、一氧化氮、氧化铝、氧化镁等,
故答案为:单质有铁、铝、金、碳、稀有气体等;化合物有酸、碱、盐、氧化物,酸有醋酸,硝酸、碳酸等,碱如氢氧化钠,氢氧化钙、氢氧化钾、一水合氨等;盐有硫酸亚铁、硫化钠等,氧化物有二氧化碳、一氧化碳、一氧化氮、氧化铝、氧化镁等.
点评 本题考查了物质分类的方法,物质组成的理解应用,掌握物质类别的特征和组成是解题关键,题目较简单.

练习册系列答案
相关题目
16.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 一定条件下,将1molN2和3molH2混合,充分反应后转移的电子数为NA | |
| B. | 1.5molNO2与足量水反应,转移的电子数为1.5NA | |
| C. | 6.4g由S2、S4、S8组成的混合物含硫原子数为0.2NA | |
| D. | 常温常压下,11.2LCl2含氯原子数为NA |
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下的33.6 L氯气与27 g铝充分反应,转移的电子数为3NA | |
| B. | 标准状况下,0.5 NA 个NO和0.5 NA 个O2混合气体的体积约为22.4 L | |
| C. | 一定条件下,将1 mol N2与3 mol H2混合反应后,生成NH3分子的数目为2NA | |
| D. | 在电解CuSO4溶液的实验中,测得电解后溶液pH=0,又知电解后溶液体积为1 L,在阳极析出的气体分子数约为0.25NA |
10.设阿伏加德罗常数的值为NA,下列说法正确的是( )
| A. | 1 mol硫酸钾中阴离子所带电荷数为NA | |
| B. | 标准状况下,分子数为NA的CO、N2混合气体体积约为22.4 L,质量为28 g | |
| C. | 铝跟氢氧化钠溶液反应,生成3.36 L H2,转移的电子数为0.3 NA | |
| D. | 50 mL 8 mol/L的浓盐酸与足量的MnO2加热反应,生成Cl2的分子数为0.1NA |
20.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
(1)在25℃、101kPa时,8g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式是CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)已知:C(s)+O2(g)═CO2(g)△H=-437.3kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ•mol-1.如果该反应△S=+133.7J•K-1•mol-1该反应在常温(25℃)下能否自发进行?(△G=△H-T△S)不能,常温(25℃)下,△G=△H-T△S=131.5kJ/mol-298K×0.1337kJ•K-1•mol-1=+91.66kJ/mol>0,反应不能自发进行.(填“能”或“不能”,并写出判断依据).
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2+3H2?2NH3△H=a kJ•mol-1.试根据表中所列键能数据估算a的数值为-93.
(1)在25℃、101kPa时,8g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式是CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)已知:C(s)+O2(g)═CO2(g)△H=-437.3kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ•mol-1.如果该反应△S=+133.7J•K-1•mol-1该反应在常温(25℃)下能否自发进行?(△G=△H-T△S)不能,常温(25℃)下,△G=△H-T△S=131.5kJ/mol-298K×0.1337kJ•K-1•mol-1=+91.66kJ/mol>0,反应不能自发进行.(填“能”或“不能”,并写出判断依据).
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
4.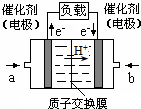 可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法中正确的是( )
可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法中正确的是( )
 可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法中正确的是( )
可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法中正确的是( )| A. | 右边的电极为电池的负极,b处通入的是空气 | |
| B. | 左边的电极为电池的负极,a处通入的是甲醇 | |
| C. | 电池负极的反应式为:CH3OH+H2O═CO2+6H++4e- | |
| D. | 电池正极的反应式为:O2+2H2O+4e-═4OH- |

 ;
;