题目内容
【题目】铝及其化合物在生产生活中具有重要的作用。
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)___________
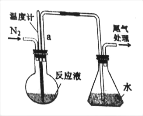
(2)铝电池性能优越,在现代生产、生活中有广泛的应用。铝-空气电池以其环保、安全而受到越来越多的关注,其原理如下图所示。
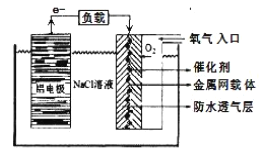
该电池的正极反应方程式为 _____;电池中NaCl溶液的作用是 ______;以该电池为电源,用惰性电极电解Na2SO4溶液,当Al电极质量减少1.8g时,电解池阴极生成的气体在标准状况下的体积为_______L。
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2。NaN3晶体中阴、阳离子个数比为______,写出反应化学方程式为___________
(4)同主族的元素应用广泛。2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
①基态Ga原子价电子排布式____,核外电子占据最高能级的电子云形状为____;基态As原子最高能层上有____个电子。
②镓失去电子的逐级电离能(单位:kJ/mol)的数值依次为577、1985、2962、6192,-1由此可推知镓的主要化合价为_____和+3,砷的第一电离能比镓_____填“大”或“小”)。
③第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为____。
④砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中C原子的杂化方式为 ______,AsH3分子的空间构型为______。
⑤相同压强下,AsH3的沸点_______NH3(填“大于”或“小于”),原因为________。
【答案】4Al+ 3O2 = 2Al2O3,表面能形成致密的氧化膜,能保护内层金属不被氧化 O2+4e-+2H2O=4OH- 增强溶液的导电能力 2.24 1:1 AlCl3+3NaN3![]() 3NaCl+4N2↑+AlN 4s24p1 哑铃形(或纺锤形) 5 +1 大 V、Co sp3 三角锥形 小于 NH3分子间含氢键
3NaCl+4N2↑+AlN 4s24p1 哑铃形(或纺锤形) 5 +1 大 V、Co sp3 三角锥形 小于 NH3分子间含氢键
【解析】
铝的化学性质比较活泼,而铝在空气中稳定存在是因为生成致密的氧化膜;该原电池中,负极上铝失电子发生氧化反应,正极上氧气得电子发生还原反应,据此书写正极反应方程式;溶液的导电性与溶液中自由离子浓度成正比;电解硫酸钠溶液时,阳极上氢氧根离子放电生成氧气,阴极上氢离子放电生成氢气,根据Al电极质量减少1.8g时结合转移电子数相等进行计算;NaN3晶体中阴离子为N3-、阳离子为Na+,AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成氮气,结合原子守恒配平书写化学方程式;根据Ga、As的原子序数,结合原子构造原理分析解答;根据电离能差值分析元素的化合价,电离能差值过大说明失去该电子较困难,同周期元素随原子序数增大,电离能增大;利用价层电子对互斥模型判断原子杂化方式和分子空间构型;分子间能形成氢键熔沸点异常高。据此分析。
(1)铝在空气中稳定存在,其原因是在常温下Al与氧气反应,铝表面能形成致密的氧化膜能保护内层金属不被氧化,反应的化学方程式为:4Al+ 3O2 = 2Al2O3;答案为:4Al+ 3O2 = 2Al2O3,表面能形成致密的氧化膜,能保护内层金属不被氧化;
(2)该原电池中,负极上铝失电子发生氧化反应,正极上氧气得电子发生还原反应,所以正极反应方程式为:O2+4e- +2H2O=4OH-,为了增大溶液的导电性且又不对其电池反应式造成影响而选择氯化钠;当Al电极质量减少1.8g时,此时转移电子数为![]() ,所以电解硫酸钠溶液时,阴极上氢离子放电生成氢气的量为
,所以电解硫酸钠溶液时,阴极上氢离子放电生成氢气的量为![]() ,则在标况下生成气体体积为
,则在标况下生成气体体积为![]() ,答案为:O2+4e-+2H2O=4OH-;增强溶液的导电能力;2.24;
,答案为:O2+4e-+2H2O=4OH-;增强溶液的导电能力;2.24;
(3) NaN3晶体中阴离子为N3-、阳离子为Na+,晶体中阴、阳离子个数比为1:1;AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成氮气,结合原子守恒书写化学方程式为:AlCl3+3NaN3![]() 3NaCl+4N2↑+AlN,答案为:1:1;AlCl3+3NaN3
3NaCl+4N2↑+AlN,答案为:1:1;AlCl3+3NaN3![]() 3NaCl+4N2↑+AlN;
3NaCl+4N2↑+AlN;
(4)①Ga是31号元素,位于第四周期第ⅢA族,核外电子排布式为[Ar]3d104s24p1,则价电子排布式为4s24p1,核外电子占据最高能级的电子云形状为哑铃形(或纺锤形);As是33号元素,位于第四周期第ⅤA族,核外电子排布式为[Ar]3d104s24p3,则基态As原子最高能层上有5个电子,答案为:4s24p1;哑铃形(或纺锤形);5;
②根据Ga失去电子的逐级电离能数值,第一电离能和第二电离能差值较大,且第三电离能和第四电离能数值差别较大,说明失去第二个电子和失去第四个电子较困难,所以呈现的价态是+1和+3;Ga、As是同一周期元素,从左到右电离能逐渐增大,砷的第一电离能比镓大,故答案为:+1;大;
③As的核外电子排布式为[Ar]3d104s24p3,核外未成对电子数目为3,第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为V、Co,故答案为:V、Co;
④(CH3)3Ga中C原子的价层电子对数为4,为sp3杂化;AsH3分子中中心原子As的价层电子对数为4,有一对孤电子对,其空间构型为三角锥形,答案为:sp3;三角锥形;
⑤相同压强下,AsH3的沸点小于NH3,因为NH3分子间能形成氢键,沸点异常高,答案为:小于;NH3分子间含氢键。

 名校课堂系列答案
名校课堂系列答案