题目内容
15.19.2g SO2在标准状况下的体积为6.72L,在25℃、105Pa下体积为7.34L,其中含氧原子的物质的量为0.6mol,该气体在标准状况下的密度是2.86g/L.分析 根据n=$\frac{m}{M}$计算二氧化硫的物质的量,根据V=nVm计算其体积,由PV=nRT,可知体积之比等于其温度之比;氧原子物质的量为二氧化硫的2倍,根据ρ=$\frac{M}{{V}_{m}}$计算标况下密度.
解答 解:二氧化硫的物质的量为$\frac{19.2L}{64g/mol}$=0.3mol,标况下体积为0.3mol×22.4L/mol=6.72L,由PV=nRT,可知压强、物质的量相同条件下,气体的体积之比等于其温度(绝对温度)之比,在25℃、105Pa下体积为为6.72L×$\frac{273+25}{273}$=7.34L,含有氧原子物质的量为0.3mol×2=0.6mol,标况下的密度为$\frac{64g/mol}{22.4L/mol}$=2.86g/L,
故答案为:6.72;7.34;0.6;2.86g/L.
点评 本题考查物质的量有关计算、阿伏伽德罗定律及推论,注意根据PV=nRT理解阿伏伽德罗定律及推论,难度不大.

练习册系列答案
相关题目
6.X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
请回答下列问题:
(1)W位于周期表中第三周期,第ⅦA族.
(2)X和氢可以构成+1价阳离子,其电子式是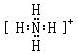 ,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
(3)X的最高价氧化物的水化物与其氢化物能化合生成M,M的水溶液显酸性的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)①Y和Z可组成一种气态化合物Q,Q能与W的单质在潮湿环境中反应,反应的化学方程式是SO2+Cl2+2H2O=2HCl+H2SO4.
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应时,每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
| X | Y | |
| Z | W |
(1)W位于周期表中第三周期,第ⅦA族.
(2)X和氢可以构成+1价阳离子,其电子式是
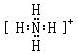 ,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).(3)X的最高价氧化物的水化物与其氢化物能化合生成M,M的水溶液显酸性的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)①Y和Z可组成一种气态化合物Q,Q能与W的单质在潮湿环境中反应,反应的化学方程式是SO2+Cl2+2H2O=2HCl+H2SO4.
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应时,每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
3.硫代硫酸钠(Na2S2O3)俗称海波,它可看成是用一个S原子取代了Na2SO4中的一个O原子而形成.某校化学研究性学习小组运用类比学习的思想,并通过实验探究Na2S2O3的化学性质.
提出问题:Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
实验探究:取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究.
实验结论:
探究①:Na2S2O3呈碱性,能与强酸反应.探究②:具有还原性.
问题讨论:甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化.你认为该方案不正确(填“正确,”或“不正确”),理由是因氯水过量,氯水中同样含有Cl-.
提出问题:Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
实验探究:取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究.
| 实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
| 探究① | A.用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照 | a.溶液pH=8 | i.S2O32-+H2O?HS2O3-+OH- |
| B.向pH=2的硫酸中滴加Na2S2O3溶液 | b.有淡黄色沉淀(或乳白色浑浊)和无色刺激性气味气体产生 | ii.S2O32一+2H+=S↓+SO2↑ +H2O | |
| 探究② | C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | c.氯水颜色变浅 | iii.S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ |
探究①:Na2S2O3呈碱性,能与强酸反应.探究②:具有还原性.
问题讨论:甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化.你认为该方案不正确(填“正确,”或“不正确”),理由是因氯水过量,氯水中同样含有Cl-.
10.稀释0.1mol/L的醋酸溶液,其中随水的增加而增大的有( )
(1)H+的物质的量 (2)c(H+) (3)c(OH-) (4)$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ (5)$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$.
(1)H+的物质的量 (2)c(H+) (3)c(OH-) (4)$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ (5)$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$.
| A. | (1)(3)(4) | B. | (1)(3)(5) | C. | (2)(4)(5) | D. | (1)(4)(5) |
20.将质量相等的铁片和铜片插入氯化钠溶液中,铜片与电源的正极相连,铁片与电源的负极相连,以I=1A的恒定电流强度进行电解,下列有关说法正确的是( )
| A. | 阳极上产生能够使湿润淀粉碘化钾试纸变蓝的气体 | |
| B. | 电解一段时间后,电解池的温度升高10℃,此时铁片上析出气体的速率加快 | |
| C. | 电解时钠离子向铜片电极方向移动 | |
| D. | 电解一段时间后溶液中会出现蓝色沉淀,总反应为:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2↓+H2↑ |
4.利用某些有机物的同分异构体间的转化可用来贮存热能,如原降冰片二烯(NBD)经太阳照射后转化成四环烷(Q)的反应: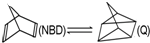 △H=+88.62kJ•mol-1,下列说法不正确的是( )
△H=+88.62kJ•mol-1,下列说法不正确的是( )
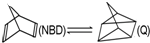 △H=+88.62kJ•mol-1,下列说法不正确的是( )
△H=+88.62kJ•mol-1,下列说法不正确的是( )| A. | 92gNBD经太阳照射后完全转化为Q时需吸收88.62kJ热量 | |
| B. | NBD可开发为贮能材料 | |
| C. | NBD、Q、甲苯三者互为同系物 | |
| D. | NBD、Q、甲苯三者是同分异构体 |
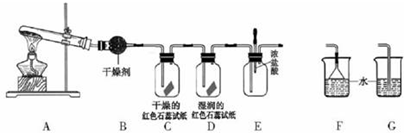
 铁(26Fe)是地球上分布最广的金属之一,约占地壳质量的5.1%,居元素分布序列中的第四位,仅次于O、Si和Al.请结合所学知识回答下列问题:
铁(26Fe)是地球上分布最广的金属之一,约占地壳质量的5.1%,居元素分布序列中的第四位,仅次于O、Si和Al.请结合所学知识回答下列问题: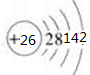
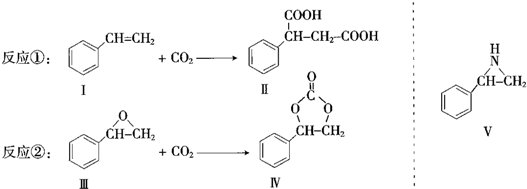
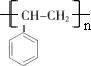 .
.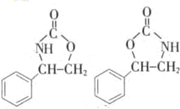 (任写一种).
(任写一种).