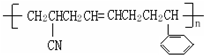题目内容
10.稀释0.1mol/L的醋酸溶液,其中随水的增加而增大的有( )(1)H+的物质的量 (2)c(H+) (3)c(OH-) (4)c(H+)c(CH3COOH) (5)c(CH3COOH)c(CH3COO−).
| A. | (1)(3)(4) | B. | (1)(3)(5) | C. | (2)(4)(5) | D. | (1)(4)(5) |
分析 用水稀释0.1mol/L醋酸时,溶液中随着水量的增加,由CH3COOH?CH3COO-+H+可知,n(CH3COO-)、n(H+)增大,但溶液的体积增大的多,则C(CH3COO-)、c(H+)减小,则c(OH-)增大,加水促进电离,则c(CH3COOH)减少.
解答 解:①加水稀释,促进醋酸电离,则H+的物质的量增大,故正确;
②加水稀释,促进醋酸电离,则H+的物质的量增大,但氢离子的物质的量增大程度远远小于溶液体积增大程度,所以c(H+)减小,故错误;
③加水稀释,促进醋酸电离,则H+的物质的量增大,但氢离子的物质的量增大程度远远小于溶液体积增大程度,所以c(H+)减小,温度不变,水的离子积常数不变,则c(OH-)增大,故正确;
④加水稀释,促进醋酸电离,但氢离子浓度减小,醋酸浓度也减小,但氢离子浓度减小的程度小于醋酸浓度减小的程度,所以c(H+)c(CH3COOH)增大,故正确;
⑤加水稀释,促进醋酸电离,但醋酸根离子浓度减小,醋酸浓度也减小,但醋酸根离子浓度减小的程度小于醋酸浓度减小的程度,所以c(CH3COOH)c(CH3COO−)减小,故错误;
故选A.
点评 本题考查了弱电解质的电离,难度较大,加水稀释促进醋酸电离,氢离子的物质的量增大程度远远小于溶液体积增大程度,所以c(H+)减小,很多学生认为氢离子浓度增大,为易错点.

练习册系列答案
相关题目
20.下列有关化学用语使用正确的是( )
| A. | NH4Br的电子式: | |
| B. | S2-的结构示意图: | |
| C. | 氚表示为:21D | |
| D. | 原子核内有l8个中子的氯原子:3617Cl |
18.分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是( )
| A. | H2SO4是酸,因为H2SO4中含有氢元素 | |
| B. | 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间 | |
| C. | Na和H2O的反应不是离子反应,因为反应中没有离子参加 | |
| D. | Na在Cl2中燃烧不是氧化还原反应,因为没有得氧或失氧 |
2.下列叙述中,不属于氮的固定的方法是( )
| A. | 根瘤菌把氮气变为硝酸盐 | B. | 氮气和氢气合成氨 | ||
| C. | 从液态空气中分离氮气 | D. | 氮气和氧气合成一氧化氮 |
19.甲醚和乙醇互为同分异构体,其鉴别可采用化学方法或物理方法,也可以使用仪器鉴定法,下列鉴别方法,不能对二者进行区别的是( )
| A. | 加入金属钠 | B. | 利用质谱法 | ||
| C. | 利用红外光谱 | D. | 利用核磁共振氢谱仪 |
20.x、y、z为三种元素的原子,已知x的阴离子与y、z的阳离子具有相同的电子层结构,且三种离子中z的阳离子半径最小,由此可知( )
| A. | 原子半径:x>y>z | B. | 电负性:x>z>y | ||
| C. | 原子序数:y>z>x | D. | 第一电离能:z>y>x |
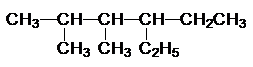 ; TNT:
; TNT: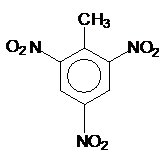 ;
;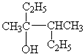 :3,4-二甲基-3-己醇,
:3,4-二甲基-3-己醇,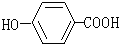 :对羟基苯甲酸.
:对羟基苯甲酸.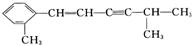 该分子中最多有13个C原子共处同一平面
该分子中最多有13个C原子共处同一平面 .
.