题目内容
5.某中学化学研究性学习小组利用以下装置制取并探究氨气的性质.A中试管内盛放的物质是Ca(OH)2、NH4Cl固体.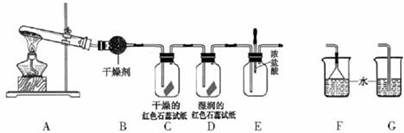
【实验探究】
(1)A中发生反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)B中盛放的干燥剂为碱石灰,干燥氨气能否用浓硫酸不能(填“能”或“不能”)
(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是4.48L
(4)实验室收集氨气的方法是向下排空气法
(5)C、D装置中颜色会发生变化的是D(填“C”或“D”),红色石蕊试纸变成蓝色
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是产生大量白烟.
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是F(填“F”或“G”).
分析 (1)实验室用氯化铵与氢氧化钙反应制备氨气;
(2)氨气为碱性气体,应选择碱性干燥剂;
(3)根据方程式计算;
(4)氨气密度小于空气,应采用向下排气法收集;
(5)氨气能使湿润的红色石蕊试纸变蓝;
(6)氨气与挥发的HCl会生成白烟;
(7)因为氨气极易溶于水,所以吸收氨气时要用防倒吸装置.
解答 解:(1)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气和水,化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氨气为碱性气体,应选择碱性干燥剂碱石灰干燥,浓硫酸具有酸性能与氨气反应,不能干燥氯气;
故答案为:碱石灰; 不能;
(3)n(NH4Cl)=$\frac{10.7g}{53.5g/mol}$=0.2mol,根据反应方程式可知,n(NH3)=n(NH4Cl)=0.2mol,所以V(NH3)=n•Vm=0.2mol×22.4L/mol=4.48L;
故答案为:4.48;
(4)氨气密度小于空气,应采用向下排气法收集,故答案为:向下排空气法;
(5)氨气能使湿润的红色石蕊试纸变蓝,所以D中颜色发生变化,故答案为:D;蓝色;
(6)氨气与挥发的HCl会生成氯化铵晶体,所以有白烟生产,故答案为:有白烟生成;
(7)因为氨气极易溶于水,所以吸收氨气时要用防倒吸装置,故答案为:F.
点评 本题考查了氨气的制备及氨气的性质,掌握制备原理及氨气的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
6.硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se) 的保健品已经进入市场,已知它与氧元素同主族,与 K 同周期,关于硒的说法中不正确的是( )
| A. | 硒化氢比硫化氢稳定 | |
| B. | 原子序数为 34 | |
| C. | 最高价氧化物的水化物的分子式为:H2SeO4 | |
| D. | Se 的非金属性比 Br 弱 |
16.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( )
| A. | 干冰和碘分别变为气体 | B. | 干冰和氯化铵分别受热变为气体 | ||
| C. | 二氧化硅和铁分别受热熔化 | D. | 食盐和葡萄糖分别溶解在水中 |
13.在反应:C(s)+CO2(g)=2CO(g)中,可使反应速率增大的措施是( )
①增大压强②升高温度③恒容通入CO2④增加碳的量⑤恒容通入N2.
①增大压强②升高温度③恒容通入CO2④增加碳的量⑤恒容通入N2.
| A. | ①②③⑤ | B. | ①②③④⑤ | C. | ①②③ | D. | ②③④ |
20.下列有关化学用语使用正确的是( )
| A. | NH4Br的电子式: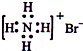 | |
| B. | S2-的结构示意图: | |
| C. | 氚表示为:${\;}_{1}^{2}$D | |
| D. | 原子核内有l8个中子的氯原子:${\;}_{17}^{36}$Cl |
10.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| B. | 7.8g Na2O2固体中阴、阳离子总数为0.4NA | |
| C. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| D. | 1L浓度为1mol•L-1的Na2CO3溶液中含有NA个CO${\;}_{3}^{2-}$ |
17.根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价,
部分短周期元素的原子半径及主要化合价,
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.075 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R,金属性L>Q | |
| B. | M与T形成的化合物具有两性 | |
| C. | L2+与R2-的核外电子数相等 | |
| D. | L的原子半径最大,电负性最小,T的原子半径最小,电负性最大 |
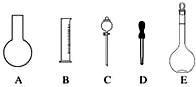 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题: