题目内容
11.在下列晶体中:NaOH.Na2S.(NH4)2S.Na2O2.C2H2.SiC.金刚石(1)其中只含有离子键的离子晶体是Na2S;
(2)其中既含有离子键又含有极性共价键的离子晶体是NaOH、(NH4)2S;
(3)其中既含有离子键,又含有极性共价键和配位键的离子晶体是(NH4)2S;
(4)其中既含有离子键又含有非极性共价键的离子晶体是Na2O2;
(5)其中含有极性共价键和非极性共价键的非极性分子是C2H2;
(6)其中含有极性共价键的原子晶体是SiC.
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物为离子化合物,其晶体为离子晶体,只含共价键的化合物为共价化合物,形成的晶体为原子晶体或分子晶体,含有孤电子对和含有空轨道的原子之间形成配位键,以此解答该题.
解答 解:NaOH中含有离子键和共价键,为离子化合物,其晶体为离子晶体;
Na2S中只含离子键,为离子化合物,其晶体为离子晶体;
(NH4)2S中含有离子键、共价键和配位键,为离子晶体;
Na2O2中含有离子键和非极性共价键,为离子晶体;
C2H2中含有极性共价键和非极性共价键,为分子晶体;
SiC晶体中只含极性键,为原子晶体;
金刚石含有非极性键,为原子晶体.
(1)其中只含有离子键的离子晶体是Na2S,故答案为:Na2S;
(2)其中既含有离子键又含有极性共价键的离子晶体是:NaOH、(NH4)2S,故答案为:NaOH、(NH4)2S;
(3)其中既含有离子键,又含有极性共价键和配位键的离子晶体是(NH4)2S,故答案为:(NH4)2S;
(4)其中既含有离子键又含有非极性共价键的离子晶体是Na2O2,故答案为:Na2O2;
(5)其中含有极性共价键和非极性共价键的非极性分子是C2H2,故答案为:C2H2;
(6)其中含有极性共价键的原子晶体是SiC,故答案为:SiC.
点评 本题考查化学反应及化学键,为高频考点,把握化学键判断的一般规律分析化学键的断裂和形成为解答的关键,注重分析能力和基础知识的考查,题目难度不大.

练习册系列答案
相关题目
1.下列措施对增大反应速率明显有效的是( )
| A. | Na与水反应时增大水的用量 | |
| B. | CaCO3与盐酸反应制取CO2时,改用浓硫酸 | |
| C. | C(s)+H2O(g)?CO(g)+H2(g),将碳块改成碳粉进行实验 | |
| D. | 粗锌与盐酸反应,将粗锌换成纯锌 |
2.有4种有机物:
①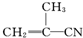 ②
②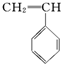 ③
③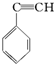 ④CH3-CH═CH-CN,其中可用于合成结构简式为
④CH3-CH═CH-CN,其中可用于合成结构简式为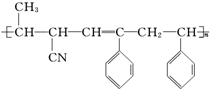 的高分子材料的正确的组合为( )
的高分子材料的正确的组合为( )
①
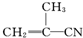 ②
② ③
③ ④CH3-CH═CH-CN,其中可用于合成结构简式为
④CH3-CH═CH-CN,其中可用于合成结构简式为 的高分子材料的正确的组合为( )
的高分子材料的正确的组合为( )| A. | ①③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
6.已知2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g).是工业制H2SO4的一个重要的反应,控制此反应条件,使之向有利于生成SO3的反应方向进行,下列有关叙述错误的是( )
| A. | 使用催化剂(V2O5)可提高该反应的反应速率 | |
| B. | 定期抽走SO3,有利于提高SO3的产率 | |
| C. | 增大O2的浓度,有利于提高SO2的转化率 | |
| D. | 增大SO2的浓度,有利于提高SO2的转化率 |
16.下列关于煤、石油、天然气等资源的说法正确的是( )
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 天然气是一种清洁的化石燃料 | |
| C. | 石油产品都可用于聚合反应 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
3.决定化学反应速率的主要因素是( )
| A. | 催化剂 | B. | 温度、压强以及反应物的接触面 | ||
| C. | 反应物的浓度 | D. | 参加反应的物质本身的性质 |
20.既可以鉴别乙烷和乙烯,又可以用来除去乙烷中的乙烯的方法是( )
| A. | 通过足量NaOH溶液 | B. | 通过足量的溴水 | ||
| C. | 在Ni粉催化、加热条件下通入H2 | D. | 通入足量的KMnO4 酸性溶液 |